- RubisCO
-
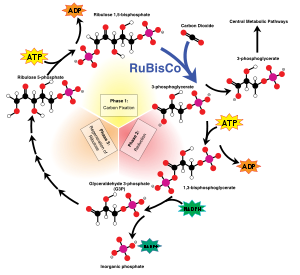
Ribulose-1,5-diphosphate carboxylase/oxygénase (RuBisCO) N° EC EC N° CAS Bases de données IntEnz Vue IntEnz BRENDA Entrée BRENDA IUBMB 4.1.1.39 à l'IUBMB KEGG Entrée KEGG MetaCyc Voie métabolique PRIAM Profil PDB Structures GO AmiGO / EGO La RuBisCO[1], de son nom complet ribulose-1,5-diphosphate carboxylase/oxygénase, est l'enzyme clé permettant la fixation du dioxyde de carbone CO2 dans la biomasse végétale en initiant le cycle de Calvin, en relation avec l'énergie solaire captée par la chlorophylle à l'origine des processus de photosynthèse. Elle catalyse aussi bien la carboxylation que l'oxydation du ribulose-1,5-diphosphate.
La RuBisCO sous ses différentes formes est la protéine la plus abondante sur Terre, où elle représente environ 50 % des protéines solubles dans les feuilles des plantes en C3 et 30 % dans celles en C4 (respectivement 20-30 % et 5-9 % de l'azote contenu dans ces feuilles)[2]. En raison de sa prépondérance, cette enzyme joue un rôle essentiel dans le cycle du carbone de notre planète : de nombreuses archées et bactéries fixent en effet le carbone par le cycle du 3-hydroxypropionate ou par le cycle de Krebs inverse, mais ne comptent que pour une faible part dans le total ; la phosphoénolpyruvate carboxylase est également capable de fixer le carbone dans le métabolisme acide crassulacéen et dans celui des plantes en C4, mais dans le but de le transporter pour fixation définitive par la RuBisCO.
Sommaire
Structure
Chez les plantes, les algues, les cyanobactéries et les protéobactéries phototrophes et chimiotrophes, la RuBisCO est généralement constituée de deux types de sous-unités : de grandes sous-unités (dites « L ») de 55 kDa et de petites sous-unités (dites « S ») de 13 kDa[3]. D'une manière générale, les petites sous-unités sont codées par le matériel génétique du noyau et sont importées dans le stroma des chloroplastes à travers les membranes externe et interne de cet organite[4],[5]. Une RuBisCO complète compte typiquement huit sous-unités L et huit sous-unités S, formant un complexe protéique d'environ 540 kDa.
Les sites actifs de l'enzyme se trouvent sur des dimères de sous-unités L, chacune des deux sous-unités du dimère contribuant à la formation du site actif. Certains dinoflagellés et certaines protéobactéries ont d'ailleurs une RuBisCO constituée d'un simple dimère de sous-unités L.
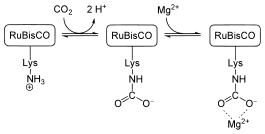
Des cations Mg2+ sont nécessaires pour assurer l'activité enzymatique de la protéine. Le positionnement correct de ces cations nécessite également une molécule de dioxyde de carbone « d'activation », qui n'est pas métabolisée mais forme un carbamate avec un résidu lysine du site actif ; la formation de carbamate est favorisée à pH basique. La concentration en Mg2+ et le pH augmentent dans le stroma des chloroplastes sous l'effet de la lumière.
Activité
Activité carboxylase
La carboxylation catalysée par la RuBisCO peut s'écrire de façon simplifiée (et approchée compte tenu du fait que tous ces composés sont ionisés dans le cytosol) comme suit :
-
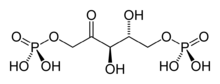
+ CO2 + H2O → 2 H* + 2 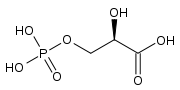
D-ribulose-1,5-diphosphate 3-phospho-D-glycérate
* Ces deux atomes d'hydrogène ne sont là que pour équilibrer la réaction ; ils correspondent en réalité
à deux cations hydronium H3O+ émis lors de l'hydrolyse du composé intermédiaire.
Le mécanisme réactionnel fait en réalité intervenir un énol, carboxylé en 3-céto-2-carboxyarabinitol-1,5-diphosphate (3-KCABP) aussitôt hydrolysé en deux trioses-phosphate :
-
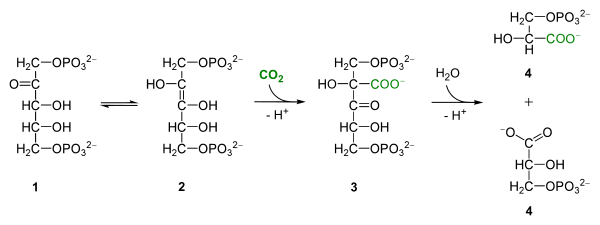 Addition de CO2 sur du ribulose-1,5-diphosphate (1) donnant deux molécules de 3-phosphoglycérate (4) via un énol (2) carboxylé en 3-céto-2-carboxyarabinitol-1,5-diphosphate (3), clivé par hydrolyse.
Addition de CO2 sur du ribulose-1,5-diphosphate (1) donnant deux molécules de 3-phosphoglycérate (4) via un énol (2) carboxylé en 3-céto-2-carboxyarabinitol-1,5-diphosphate (3), clivé par hydrolyse.
Activité oxygénase
L'oxygénation catalysée par la RuBisCO peut s'écrire de façon simplifiée comme suit :
-

+ O2 → 2 H* + 
+ 
D-ribulose-1,5-diphosphate 3-phospho-D-glycérate 2-phosphoglycolate
* Ces deux atomes d'hydrogène sont là pour équilibrer la réaction ; ils correspondent en réalité à deux cations hydronium H3O+.
Le 2-phosphoglycolate produit par cette réaction est recyclé à travers la photorespiration, qui fait intervenir des enzymes situées dans les mitochondries et les peroxysomes : deux molécules de phosphoglycolate sont converties en CO2 et en 3-phosphoglycérate, qui peut être à son tour recyclé dans le cycle de Calvin. Une partie du phosphoglycolate peut être également convertie en glycine.
Aux concentrations normales de dioxyde de carbone et d'oxygène dans l'atmosphère terrestre, le rapport entre l'activité carboxylase et l'activité oxygénase de la RuBisCO est d'environ 4:1. Ce rapport diminue lorsque la température augmente, ce qui a favorisé des adaptations métaboliques particulières chez certaines plantes tropicales (plantes dites « en C4 ») et certaines plantes grasses (métabolisme acide crassulacéen, ou « CAM ») pour concentrer le CO2 autour de la RuBisCO :
- les « plantes en C4 » fixent le CO2 sur le phosphoénolpyruvate dans le mésophylle par l'action successive de l’anhydrase carbonique et de la phosphoénolpyruvate carboxylase pour donner de l'oxaloacétate, ultérieurement converti en malate, lequel migre ensuite vers les cellules de la gaine périvasculaire pour y libérer le CO2 afin d'être métabolisé par la RuBisCO sans être trop concurrencé par l'oxygène.
- les « plantes CAM » disposent du même matériel enzymatique mais accumulent le malate pendant la nuit pour le métaboliser par la RuBisCO pendant la journée, lorsque les stomates sont fermés pour limiter les pertes d'eau par transpiration.
La RuBisCO n'est pas une enzyme très rapide : chacune d'elle ne fixe qu'entre trois et dix molécules de CO2 par seconde[6].
-
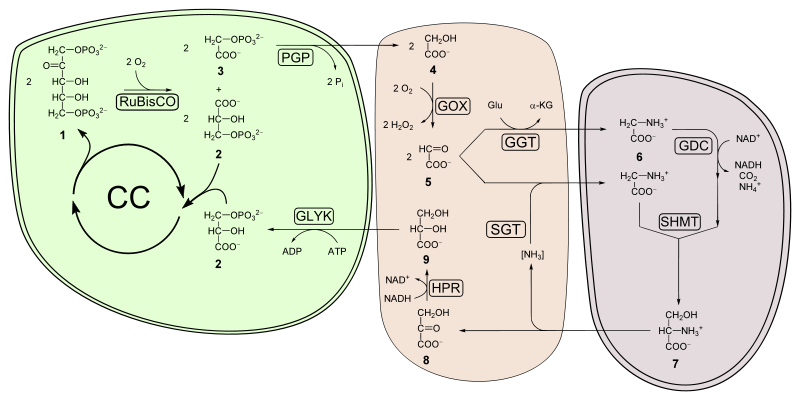 Photorespiration et métabolisme associé. CC représente le cycle de Calvin, tandis que les métabolites suivants sont indiqués par des numéros :
Photorespiration et métabolisme associé. CC représente le cycle de Calvin, tandis que les métabolites suivants sont indiqués par des numéros :
1 ribulose-1,5-diphosphate,
2 3-phosphoglycérate,
3 2-phosphoglycolate,
4 glycolate,
5 glyoxylate,
6 glycine,
7 sérine,
8 hydroxypyruvate,
9 glycérate.
Régulation
La RuBisCO n'est normalement active que pendant la journée, car c'est dans la journée seulement qu'est produit le ribulose-1,5-diphosphate en raison de la régulation de plusieurs autres enzymes du cycle de Calvin. Plusieurs autres facteurs contribuent à coordonner l'activité de la RuBisCO avec celle des autres enzymes de ce cycle.
Régulation ionique
Le pH du stroma des chloroplastes augmente de 7.0 à 8.0 pendant l'illumination diurne sous l'effet du gradient de protons généré à travers les membranes thylakoïdes qui a pour effet de concentrer les protons à l'intérieur des thylakoïdes et donc d'en diminuer la concentration dans le stroma. Parallèlement, les cations Mg2+ sont pompés hors des thylakoïdes et s'accumulent dans le stroma. La RuBisCO, dont le pH optimal peut dépasser 9.0 selon la concentration en Mg2+, est par conséquent activée par fixation de CO2 avec l'aide de ce cation sur un résidu lysine du site actif de l'enzyme pour y former un carbamate indispensable à la réaction.
Régulation par la RuBisCO activase
Chez les plantes et chez certaines algues, une enzyme spécifique, la RuBisCO activase, est nécessaire pour catalyser la formation du carbamate avant que celle-ci ne soit bloquée par la liaison du substrat, lequel se lie plus fortement à l'enzyme inactive (sans carbamate) qu'à l'enzyme carbamylée : la RuBisCO activase libère le ribulose-1,5-diphosphate lié à la RuBisCO inactive, permettant l'activation de cette dernière par le dioxyde de carbone. Cette enzyme est également nécessaire à certaines plantes (notamment Nicotiana tabacum et certains haricots) dont le métabolisme produit un inhibiteur compétitif, le 2-carboxyarabinitol-1-phosphatase, déphosphoryle le CA1P en protéolyse. Par ailleurs, à température élevée, la RuBisCO activase tend à former des agrégats inactifs qui ne sont plus en mesure de maintenir l'activité de la RuBisCO : cette particularité pourrait être mise à profit afin de limiter la photorespiration nocturne.
Régulation de l'activase par le ratio ATP/ADP et par l'état redox de la thiorédoxine du stroma
L'élimination du RuBisCO activase consomme de l'ATP et est inhibée par l'ADP. L'activité de l'activase est donc déterminée par le ratio ATP/ADP, mais la sensibilité de cette enzyme à ce ratio est elle-même conditionnée, dans la plupart des plantes, par l'état redox moyen des molécules de thiorédoxine du stroma des chloroplastes. Le niveau d'activité de l'activase, et donc de la RuBisCO, dépend ainsi de l'intensité lumineuse, ce qui permet de la corréler à la formation du ribulose-1,5-diphosphate.
Régulation par le phosphate inorganique
Chez les cyanobactéries, le phosphate inorganique se lie au site actif de la RuBisCO ainsi qu'à un autre site sur les grandes sous-unités, modulant ainsi les transitions entre états actif et inactif de la RuBisCO. Le phosphate inorganique pourrait jouer, chez ces bactéries, un rôle similaire à celui de la RuBisCO activase des plantes supérieures.
Régulation par le dioxyde de carbone
Le dioxyde de carbone et l'oxygène étant en compétition dans le site actif de la RuBisCO, l'efficacité de l'enzyme quant à la fixation du CO2 peut être améliorée par accroissement de la concentration en CO2 dans le stroma des chloroplastes, où se trouve la RuBisCO. C'est d'ailleurs l'objet de certaines adaptations métaboliques à l'œuvre dans les plantes dites « en C4 » et celles dites « CAM ». Le fait qu'O2 soit en concurrence avec le CO2 peut être suprenant dans la mesure où la photorespiration aboutit à perdre de l'énergie fixée par photosynthèse et peut même annuler le flux net de CO2 fixé par la RuBisCO dans des feuilles saines en plein lumière.
La vitesse relative des activités carboxylase et oxygénase de la RuBisCO dépendent en premier lieu de la température, car une température élevée réduit le taux de CO2 dissous dans les tissus et favorise donc l'activité oxygénase, c'est-à-dire la photorespiration. Or la température dépend de l'hydratation de la plante, car c'est la transpiration qui permet de refroidir les feuilles.
Optimisation de la RuBisCO par génie génétique
Le rendement photosynthétique d'une cellule se définit comme la fraction d'énergie lumineuse convertie par cette cellule en énergie chimique. Plus il est élevé, et plus la plante est en mesure d'absorber du CO2 pour le convertir en glucides et, in fine, en toute la gamme de biomolécules qui constituent sa physiologie. La RuBisCO étant le facteur limitant du rendement photosynthétique global des organismes qui reposent sur cette enzyme, en accroître l'efficacité catalytique — en augmentant celle de l'activité carboxylase et/ou en réduisant celle de l'activité oxygénase — pourrait favoriser la séquestration écologique du CO2 par voie biologique — on parle de « bioséquestration » — et constituer une option valable dans le contrôle du taux atmosphérique des gaz à effet de serre en partie responsables du réchauffement climatique.
Les approches qui ont commencé à être investiguées passent par l'expression de gènes de RuBisCO d'une espèce dans une autre espèce, la stimulation de l'expression de certaines sous-unités de la RuBisCO, l'expression des gènes des sous-unités S directement depuis les plastomes (c'est-à-dire le matériel génétique chloroplastique), voire la modification des gènes codant les sous-unités de la RuBisCO pour en augmenter la spécificité au CO2 ou en accroître la vitesse de fixation du carbone. Une voie prometteuse semble ainsi être d'introduire, dans des plantes cultivées, des gènes de RuBisCO plus performante, par exemple ceux de rhodophytes telles que Galdieria partita : la RuBisCO du tabac a ainsi été remplacée par celle d'une protéobactérie, Rhodospirillum rubrum.
Références
- Le terme RuBisCO a été forgé en 1979 par le biochimiste américain David S. Eisenberg lors d'un séminaire marquant le départ à la retraite de Samuel G. Wildman, éminent spécialiste de cette enzyme. L'abréviation dérive de l'appellation anglophone « ribulose-1,5-bisphosphate carboxylase/oxygenase, » avec un clin d'œil aux snacks Nabisco en souvenir de la tentative malheureuse de Wildman de créer des feuilles de tabac commestibles. cf. :
(en) Samuel G. Wildman, « Along the trail from Fraction I protein to Rubisco (ribulose bisphosphate carboxylase-oxygenase) », dans Photosynthesis Research, vol. 73, no 1-3, 2002, p. 243-250
DOI:10.1023/A:1020467601966 - (en) Urs Feller1 Iwona Anders et Tadahiko Mae, « Rubiscolytics: fate of Rubisco after its enzymatic function in a cell is terminated », dans Journal of Experimental Botany, vol. 59, no 7, 1er novembre 2007, p. 1615-1624 [texte intégral (page consultée le 7 janvier 2011)]
DOI:10.1093/jxb/erm242 - (en) Le gène des sous-unités L font partie du génome des chloroplastes chez les plantes (Entrez GeneID: )
- (en) A. Dhingra, A. R. Portis, H. Daniell, « Enhanced translation of a chloroplast-expressed RbcS gene restores small subunit levels and photosynthesis in nuclear RbcS antisense plants », dans Proc. Natl. Acad. Sci. U.S.A., vol. 101, no 16, avril 2004, p. 6315–6320 [texte intégral (page consultée le 27 décembre 2010)]
DOI:10.1073/pnas.0400981101 - (en) M. Yoon, J. J. Putterill, G. S. Ross, W. A. Laing, « Determination of the relative expression levels of rubisco small subunit genes in Arabidopsis by rapid amplification of cDNA ends », dans Anal. Biochem., vol. 291, no 2, avril 2001, p. 237–244 [texte intégral (page consultée le 27 décembre 2010)]
DOI:10.1006/abio.2001.5042 - (en) R. John Ellis, « Biochemistry: Tackling unintelligent design », dans Nature, vol. 463, 14 janvier 2010, p. 164-165 [texte intégral (page consultée le 26 décembre 2010)]
DOI:10.1038/463164a
Liens externes
-
Wikimedia Foundation. 2010.