- Cœliakie
-
Maladie cœliaque
Maladie cœliaque CIM-10 : K90.0 La maladie cœliaque (parfois appelée cœliaquie ou intolérance au gluten ou sprue, prononcée /seljak/), est une maladie auto-immune, caractérisée par une atteinte de tout ou partie des villosités recouvrant l'intestin grêle. Cette maladie est due à une intolérance au gluten et aux protéines apparentées que l'on trouve dans certaines céréales (blé, seigle, orge, épeautre, avoine). Il en résulte une malabsorption et donc des carences alimentaires. Les personnes cœliaques doivent s'abstenir à vie de consommer les produits contenant ces glutens, ce qui permet une régression complète des symptômes de la maladie.
Sommaire
Causes
Il existe une nette prédisposition familiale à la maladie cœliaque dont la prévalence est de l’ordre de 10 % chez les parents de premier degré d’un patient atteint. La maladie n'est présente essentiellement que chez des patients porteurs de certains groupes HLA (HLA-DQ2 ou HLA-DQ8) mais la présence de ces groupes ne signifient pas, pour autant, être porteur de la maladie[1].
En dehors de ces prédispositions génétiques, d’autres facteurs environnementaux, probablement infectieux, viraux et/ou bactériens encore mal connus, sont susceptibles de déclencher la phase active de la maladie (la responsabilité d’un rotavirus est parfois mise en cause[2]).
D’autres facteurs pourraient aussi avoir un rôle tels une introduction trop précoce du gluten dans le régime alimentaire du nourrisson[3]. L'allaitement maternel serait, au contraire, un facteur protecteur[4].
La maladie cœliaque a deux pics de fréquence avec une révélation soit dans la petite enfance, le plus souvent entre six mois et deux ans soit après l'introduction du gluten dans le régime alimentaire, ou à l'âge adulte le plus souvent entre 20 et 40 ans. Les formes à révélation tardive (après 65 ans) ne sont cependant pas rares.
Le gluten
Techniquement, le gluten est un résidu protéique de l'extraction de l'amidon du blé. Mais l'appellation a été étendue par l'industrie agroalimentaire à d'autres protéines provenant d'autres céréales que le blé. Par exemple, le "gluten de maïs", ne présente aucun risque de consommation pour les malades[5]. Ces protéines sont classées en deux groupes :les prolamines et les gluténines.
Les composants toxiques dans la maladie cœliaque sont certaines prolamines :
- les a-gliadines du blé et de ses différentes variétés moins utilisées, comme l’épeautre ou le kamut et le froment.
- les hordénines de l’orge.
- les sécalines du seigle.
- les prolamines du triticale, un hybride de blé et de seigle.
- Les avénines de l'avoine ont été classées dans les protéines toxiques pour les malades cœliaques. Néanmoins, ce classement est aujourd'hui remis en cause, et leur consommation pourrait ne pas provoquer de lésions intestinales[6].
Physiopathologie
Le gluten est une protéine se trouvant dans beaucoup de céréales. Il se transforme en gliadine dans le tube digestif. La pénétration de cette dernière dans la paroi intestinale chez des sujets prédisposés provoquerait une réaction inflammatoire entraînant la destruction des cellules composant les villosités intestinales[7]. Cette intolérance au gluten est d’origine immunologique, mais sans réaction d'hypersensibilité. Ce n'est donc pas une allergie.
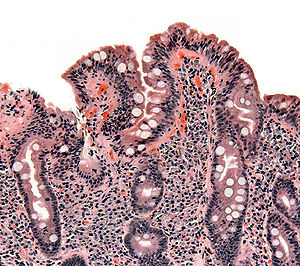
À la phase active de la maladie, avant le diagnostic et donc l'instauration d'un régime excluant le gluten, la majorité des malades ont une atrophie totale ou subtotale des villosités (disparition de ces dernières) au niveau de la paroi intestinale avec une nette augmentation du nombre de lymphocytes dans l'épithélium de cette dernière.
Cette atrophie est prédominante au niveau de l'intestin grêle proximal mais peut, quand l'atteinte est importante, être visible sur l'ensemble de l'intestin grêle. Elle conduit alors à un syndrome de malabsorption plus ou moins total avec notamment une malabsorption de la vitamine B12 au niveau du grêle distal. Le taux sanguin de cette dernière est alors très abaissé.
Épidémiologie
On trouve généralement cette maladie chez l'enfant, mais le diagnostic peut-être fait chez l'adulte quand la maladie était discrète pendant l'enfance.
Cette maladie touche surtout les populations d'Europe du Nord. Des estimations de sa fréquence parmi les personnes d'origine européenne varient entre 1 sur 300 et 1 sur 500. Parmi les irlandais, la prévalence atteindrait 1 sur 132, tandis que la prévalence moyenne au Royaume-Uni serait de 1 sur 100[8]. Cette prévalence différente est en partie due à la disparité des diagnostics portés.
En raison de sa nature en partie génétique, les médecins recommandent généralement que les proches parents de patients atteints passent un test même s'ils ne présentent aucun symptôme.
Elle est deux à trois fois plus fréquente chez la femme. Ce sex-ratio s’atténue actuellement, avec l’augmentation du taux de diagnostic des formes cliniquement asymptomatiques (sans signe apparent).
Signes et symptômes
Les signes les plus fréquents sont :
- une fatigabilité (asthénie),
- des douleurs abdominales et une diarrhée de type malabsorption avec stéatorrhée (selles graisseuses), amaigrissement et dénutrition.
On peut aussi trouver des anomalies biologiques qui sont des signes indirects de malabsorption au niveau du grêle :
- anémie associée à une carence en fer, folates, vitamine B12 ;
- Déficit en certains facteurs de la coagulation (facteurs II, VII et X) ;
- hypoprotidémie (baisse de la concentration sanguine en protéine) avec hypo-albuminémie ;
- déficit en calcium (hypocalcémie), en magnésium, en zinc ;
- diminution de la concentration sanguine en cholestérol (hypocholestérolémie).
On ne retrouve ce tableau seulement chez 20% des malades. Il peut aussi y avoir beaucoup de symptômes très différents.
Les formes atypiques ou frustres sont fréquentes. Elles sont plus fréquemment observées chez l'adulte. Leur caractère atypique entraîne souvent un retard au diagnostic. On peut ainsi observer :
- Une anémie par déficit en fer, voire un simple déficit en fer sans anémie,
- une aphtose buccale récidivante,
- des troubles menstruels tels qu'une aménorrhée primaire ou secondaire ou une stérilité,
- des avortements à répétition,
- une hypotrophie fœtale,
- une épilepsie ou une ataxie,
- des douleurs osseuses ou articulaires inexpliquées,
- une ostéoporose sans cause retrouvée, associée ou non à des fractures,
- une augmentation inexpliquée des transaminases dans le sang.
Signes physiques:
- Teint très pâle
- joues et ventre gonflés (chez le nourrisson le plus souvent)
- mauvaise haleine due a la mauvaise absorption du gluten
Diagnostic
Le diagnostic de maladie cœliaque est souvent facile quand il y a des signes cliniques digestifs. En leur absence, le diagnostic est beaucoup plus complexe.
Il repose sur trois principaux critères : sérologique, histologique et efficacité de l'exclusion du gluten.
Il existe quelque particularité chez l'adulte.
D'une part, il est essentiel de ne pas méconnaître la maladie devant des manifestations digestives ou extra-digestives qui, non traitées, pourraient entraîner de graves complications, telles qu'une dénutrition ou une atteinte neurologique.
D'autre part, poser le diagnostic chez un patient aura pour lui des conséquences très importantes puisque cela impliquera la suppression totale et définitive du gluten dans l'alimentation, donc un régime très contraignant.
Il est donc nécessaire tout à la fois d'évoquer facilement ce diagnostic devant des symptômes qui ne sont pas forcément typiques et évocateurs, mais aussi de recueillir suffisamment d'arguments pour être certain du diagnostic.
Sérologie
Le dosage des anticorps (IgA anti transglutaminase tissulaire, et, de manière moins fiable, IgA anti-gliadine) dans le sang est d'une grande sensibilité et spécificité[9]. Il est utile pour le diagnostic et le suivi du régime sans gluten. Ce dosage est cependant moins sensible en cas de formes peu avancées de la maladie[7].
Ces anticorps sont présents en cas de suspicion de maladie cœliaque et s'ils sont positifs, le diagnostic devra être confirmé par une biopsie intestinale, près de 10% de faux-positifs ayant été décrits[10].
Biopsie duodénale
La fibroscopie peut montrer des anomalies non spécifiques : plis raréfiés de la muqueuse, aspect en mosaïque… Même en cas de normalité de l'aspect, une confirmation doit être faite par biopsie de la muqueuse duodénale.
Elle doit être multiple (4 à 6 échantillons[7]) en raison d'une atteinte pouvant être partielle. Elle met en évidence une atrophie villositaire associée à une augmentation des lymphocytes intra épithéliaux et une hyperplasie des cryptes.
Autres examens
Le typage HLA n'est pas fait de manière courante, car, bien qu'assez sensible, il n'est que peu spécifique (présence des deux types dans près de 40% de la population générale[11]).
Un bilan nutritionnel doit être fait comportant le dosage de la concentration sanguine en fer, en calcium, en acide folique, en vitamine B12.
Une ostéoporose (déminéralisation des os avec risques accrus de fractures) doit être recherchée systématiquement.
Complications
Jusqu'à un tiers des maladies cœliaques répondent de manière imparfaite au régime[7]. Il faut dans ce cas réévaluer soigneusement le diagnostic et traquer les entorses au régime prescrit. Cependant, même en cas de régime fait de manière rigoureuse avec un diagnostic bien établi, 5 % des patients n'ont pas d'amélioration de leurs signes[7]. On parle alors de « maladie cœliaque réfractaire ». Dans un certain nombre de cas, il existe une prolifération de lymphocytes dans l'épithélium digestif avec une évolution possible vers un lymphome. Un traitement par corticoïdes peut être efficace à court terme[12]. D'autres médicaments ont été essayés avec un succès variable : infliximab[13], auto-greffe de moelle[14]... Le pronostic de cette forme proliférative reste cependant sombre avec une survie inférieure à 5 ans[15].
La maladie cœliaque est un facteur de risque classique de la survenue d'un cancer de l'intestin grêle (adénocarcinome), maladie rare. Cette donnée est cependant constestée[16].
D'authentiques lymphomes peuvent se développer sur des maladies cœliaques pourtant non réfractaires. Ils sont localisés au niveau du tube digestif mais peuvent survenir ailleurs. Ils surviennent après la soixantaine et doivent être suspectés lors d'une aggravation des signes sur une maladie, jusque là stabilisée.
Traitement
Le seul traitement reste de suivre un régime excluant toute source de gluten dans l'alimentation.
Le régime sans gluten doit être préconisé à vie (il n'y a pas de régression de la maladie), en particulier chez l'adulte, car il prévient en partie le risque de la survenue de lymphome (cancer sanguin) et de complications osseuses.
Le gluten se trouve essentiellement dans les farines. Le patient peut utiliser des produits estampillés « sans gluten ». Il n'est pas restreint au niveau fruits et légumes ainsi que pour la viande, les poissons, les laitages (bien évidemment, la préparation de ces produits doit exclure le gluten).
Il faut contrôler l'efficacité du régime et le bon suivi par l'observation de l'amélioration clinique et biologique après un à trois mois de régime, par la régression des anomalies à la biopsie (atrophie villositaire) et la négativation des anticorps spécifiques après un an de régime.
Il faut aussi surveiller la disparition des symptômes qui avait orienté le diagnostic (problèmes osseux…). Des compléments vitaminiques peuvent être prescrits quand l'état de santé du patient le demande.
Des traitements, à base d'absorption d'enzymes permettant de dégrader le gluten, et donc, théoriquement d'éviter le régime, sont en cours de développement[17].
Exceptionnellement, la réintroduction de gluten dans l'alimentation après un régime prolongé a pu être faite sans problème[18]. Cette attitude n'est cependant pas communément proposée.
Voir aussi
Liens externes
- Association Française Des Intolérants Au Gluten
- DigestScience - Fondation de recherche médicale contre les pathologies digestives
- Association canadienne de la maladie cœliaque
- Société Belge de la cœliaquie
- Groupe d'études et de recherche sur la maladie cœliaque de l'hôpital Georges-Pompidou
- Fondation québécoise de la maladie cœliaque
- Association suisse Romande de la Coeliakie (ARC)
Notes et références
- ↑ Sollid LM, Lie BA, Celiac disease genetics: current concepts and practical applications, Clin Gastroenterol Hepatol, 2005;3:843-851
- ↑ Stene LC, Honeyman MC, Hoffenberg EJ, et als. Rotavirus infection frequency and risk of celiac disease autoimmunity in early childhood: a longitudinal study, Am J Gastroenterol, 2006;101:2333-2340
- ↑ Norris JM, Barriga K, Hoffenberg EJ, et als. Risk of celiac disease autoimmunity and timing of gluten introduction in the diet of infants at increased risk of disease, JAMA, 2005;293:2343-2351
- ↑ Persson LA, Ivarsson A, Hernell O, Breast-feeding protects against celiac disease in childhood -- epidemiological evidence, Adv Exp Med Biol, 2002;503:115-123
- ↑ Présentation de la maladie cœliaque (1)
- ↑ Présentation de la Maladie Coeliaque (1)
- ↑ a , b , c , d et e Green PH, Cellier C, Celiac Disease, N Eng J Med, 2007;357:1731-1743
- ↑ Rostrom A, Murray JA, Kagnoff MF. American Gastroenterological Associate (AGA) Institute technical review on the diagnosis and management of celiac disease. Gastroenterology 2006;131:1981-2002
- ↑ Rostom A, Dubé C, Cranney A, et als. The diagnostic accuracy of serologic tests for celiac disease: a systematic review, Gastroenterology, 2005;128:Suppl 1:S38-S46
- ↑ Hopper AD, Cross SS, Hurlstone DP, McAlindon ME, Lobo AJ, Hadjivassiliou M, et al. Pre-endoscopy serological testing for coeliac disease: evaluation of a clinical decision tool. BMJ 2007;334:729
- ↑ Kaukinen K, Partanen J, Mäki M, Collin P, HLA-DQ typing in the diagnosis of celiac disease, Am J Gastroenterol 2002;97:695-699
- ↑ Cellier C, Delabesse E, Helmer C, et als. Refractory sprue, coeliac disease, and enteropathy-associated T-cell lymphoma, Lancet, 2000;356:203-208
- ↑ Gillett HR, Arnott ID, McIntyre M, et als. Successful infliximab treatment for steroid-refractory celiac disease: a case report, Gastroenterology, 2002;122:800-805
- ↑ Al-toma A, Visser OJ, van Roessel HM, et als. Autologous hematopoietic stem cell transplantation in refractory celiac disease with aberrant T cells, Blood, 2007;109:2243-2249
- ↑ Cellier C, Delabesse E, Helmer C, et als. Refractory sprue, coeliac disease, and enteropathy-associated T-cell lymphoma, Lancet 2000;356:203-208
- ↑ West J, Logan RF, Smith CJ, Hubbard RB, Card TR, Malignancy and mortality in people with coeliac disease: population based cohort study, BMJ, 2004;329:716-719
- ↑ Stepniak D, Spaenij-Dekking L, Mitea C, et als. Highly efficient gluten degradation with a newly identified prolyl endoprotease: implications for celiac disease, Am J Physiol Gastrointest Liver Physiol, 2006;291:G621-G629
- ↑ Matysiak-Butnik T, Malamut G, Patey-Mariaud de Serre N, et als. Long-term follow-up of 61 celiac patients diagnosed in childhood: evolution toward latency is possible on a normal diet, Gut, 2007;56:1379-1386
- Portail de la médecine
Catégories : Pédiatrie | Maladie de l'intestin grêle | Maladie inflammatoire de l'appareil digestif | Intolérance alimentaire
Wikimedia Foundation. 2010.