- Combustion érosive
-
Combustion
 Pour les articles homonymes, voir Combustion (homonymie).La combustion d'un bâton d'encens, se traduisant par la production d'une flamme
Pour les articles homonymes, voir Combustion (homonymie).La combustion d'un bâton d'encens, se traduisant par la production d'une flamme
La combustion est une réaction chimique exothermique d'oxydoréduction. Lorsque la combustion est vive, elle se traduit par une flamme voire une explosion.
Sommaire
Triangle du feu
La réaction chimique de combustion ne peut se produire que si l'on réunit trois éléments : un combustible, un comburant, une énergie d'activation en quantités suffisantes. On représente de façon symbolique cette association par le triangle du feu. De la même manière, la combustion cesse dès qu'un élément du triangle est enlevé.
Le combustible peut être :
- un solide formant des braises (bois, papier, carton, tissu, PVC, …) ;
- un liquide ou solide liquéfiable (essence, gazole, huile, kérosène, polyéthylène, polystyrène, …) ;
- un gaz (butane, propane, méthane, dihydrogène, …) ;
- un métal (fer, aluminium, sodium, magnésium, …).
Ces quatre points correspondent respectivement aux quatre principales classes de feux A, B, C et D.
Le comburant est l’autre réactif de la réaction chimique. La plupart du temps, il s’agit de l’air ambiant, et plus particulièrement de l’un de ses composants principaux, le dioxygène. En privant un feu d’air, on l’éteint ; par exemple, si on place une bougie chauffe-plat allumée dans un bocal de confiture et qu’on ferme le bocal, la flamme s’éteint ; à l’inverse, si l’on souffle sur un feu de bois, cela l’active (on apporte plus d’air). Dans certains chalumeaux, on apporte du dioxygène pur pour améliorer la combustion.
Dans certains cas très particuliers (souvent explosifs comme avec l'aluminium), le comburant et le combustible sont un seul et même corps (par exemple la célèbre nitroglycérine, molécule instable comportant une partie oxydante greffée sur une partie réductrice).
La réaction est déclenchée par une énergie d’activation. Il s’agit généralement de chaleur. Par exemple, ce sera l'échauffement du frottement dans le cas de l’allumette, le câble électrique qui chauffe, ou une autre flamme (propagation du feu), étincelle (de l’allume-gaz, de la pierre du briquet ou d’un appareil électrique qui se met en route ou s’arrête). Mais il y a d’autres façons de fournir l’énergie d’activation : électricité, radiation, pression… qui permettront toujours une augmentation de la température. La production de chaleur permet à la réaction de s’auto-entretenir dans la plupart des cas, voire de s'amplifier en une réaction en chaîne. La température à partir de laquelle un liquide émet suffisamment de vapeurs pour former avec l'air un mélange inflammable dont la combustion peut s'entretenir d'elle-même est appelée point d'inflammation.
Procédés d'extinction d'une combustion
Article détaillé : Lutte contre l'incendie.Pour éteindre une réaction de combustion, il faut supprimer un de trois éléments du triangle du feu :
- suppression du combustible : fermeture d'une vanne ou d'un robinet qui alimente la combustion, éloignement de combustibles à proximité du feu, exutoire pour chasser la fumée (qui contient des imbrûlés), …
- suppression du comburant (étouffement) : utilisation d'un extincteur à neige carbonique, d'une couverture, aspersion d'eau sur un combustible solide (la vapeur d'eau formée chasse l'air) …
- suppression de l'énergie d'activation (refroidissement) : pulvérisation d'eau dans le cas d'une atmosphère prémélangée (mélange de gaz ou de particules combustibles et de gaz comburant), grille absorbant la chaleur (lampe de mineur "Davy"), exutoire pour chasser la fumée (qui est chaude), …
L'eau peut avoir deux rôles différents :
- dans le cas d'un combustible solide, le facteur limitant est l'apport en comburant (air), le feu produisant sa propre chaleur ; l'eau étouffe donc le feu par dégagement de vapeur qui entraîne l'air et empêche l'alimentation en oxygène;
- dans le cas d'une atmosphère prémélangée, on ne peut pas séparer le combustible du comburant, la seule action possible consiste à refroidir l'atmosphère pour empêcher la flamme de se propager (la vapeur d'eau joue également un rôle de diluant).
Il existe cependant des cas où le facteur déclenchant la combustion n'est pas l'énergie d'activation. Par exemple, l'explosion de fumées est une combustion très violente des gaz imbrûlés présents dans les fumées (voir combustion incomplète) provoquée par un apport soudain d'air, donc de comburant. L'intervalle dans lequel le mélange air/gaz pourra brûler est borné par les limites d'explosivité dans l'air. Cet intervalle peut mesurer de quelques pour cent (kérosène) à plusieurs dizaines de pour cent (acétylène).
Caractéristiques
Combustion rapide
La combustion rapide est une forme de combustion au cours de laquelle de grandes quantités de chaleur et d'énergie sous forme de lumière sont relâchées, donnant naissance au feu. Elle est utilisée dans certaines machines telles que les moteurs à combustion interne ou les armes thermobariques.
Combustion lente
La combustion lente est une réaction se réalisant à des températures peu élevées.
- On peut citer le cas de la respiration cellulaire : cette lenteur due à des enzymes spécifiques permettent d'augmenter les réactions d'oxydoréduction et ainsi d'obtenir un très bon rendement par récupération d'une grande partie de l'énergie.
Combustion complète
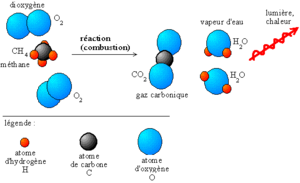
Lors d'une combustion complète, le réactif réagira avec le comburant jusqu'à former des produits qui ne pourront plus être oxydés, c'est-à-dire que ces produits ne peuvent plus réagir avec le comburant: les produits ont atteint un degré de stabilité qu'une réaction de combustion ne peut modifier. Dans le cas d'un hydrocarbure réagissant avec le dioxygène, les produits de combustion sont le dioxyde de carbone et de l'eau. Il existe pour chaque élément un produit de combustion stable, ainsi une combustion complète fournit les mêmes produits de réactions quels que soient les réactifs.
Une combustion complète permet d'obtenir la quantité maximale d'énergie disponible par une substance et cette énergie est définie comme étant le pouvoir calorifique.
Combustion turbulente
La combustion turbulente est une combustion caractérisée par des flux de chaleur. Elle est souvent utilisée dans l'industrie (par exemple, les turbines à gaz, les moteurs diesel...) car la chaleur facilite l'opération de mélange entre le combustible et l'oxydant.
Combustion incomplète
La combustion incomplète a lieu quand il n'y a pas assez de comburant pour permettre la réaction complète du combustible ou lorsque le temps de contact à une température rendant la combustion possible est trop faible. Elle produit donc des résidus de combustion, sous forme de cendres qui génèrent des fumées, dont certains composés sont très toxiques pour l'homme et pour l'environnement tel le monoxyde de carbone (gaz mortel), des particules de carbone pur (suie, goudron, cendres), des oxydes d'azote, des hydrocarbures (cancérigènes tels le benzène, ou fortement toxiques tels les HAP), des composés organiques volatiles [1].
La réaction de combustion est habituellement incomplète et seul un contrôle des conditions permet d'obtenir une combustion complète, telle la combustion en présence d'un excès d'oxygène à haute température. En cas de combustion incomplète, il est possible de traiter les fumées une seconde fois pour réduire les imbrûlés comme dans le cas des moteurs d'automobiles où les pots d'échappement et les filtre à particule permettent une seconde combustion à plus faible température grâce à des catalyseurs.
Chimie de la combustion
La combustion est une réaction chimique où des molécules complexes sont décomposées en molécules plus petites et plus stables via un réarrangement des liaisons entre les atomes. La chimie de la combustion est une composante majeure de la chimie à haute température qui implique principalement des réactions radicalaires. Toutefois il est possible de traiter la combustion via une réaction globale unique.
Exemple :Combustion du propane dans le dioxygène
H3C-CH2-CH3 + 5O2 → 3CO2 + 4H2O Le dioxyde de carbone CO2 et l’eau H2O sont plus stables que le dioxygène et le propane.
La combustion est une réaction d'oxydo-réduction, en l’occurrence l’oxydation d’un combustible par un comburant ;
- le combustible est le corps qui est oxydé durant la combustion ; c'est un réducteur, il perd des électrons ;
- le comburant est le corps qui est réduit ; c'est un oxydant, il gagne des électrons.
Comme pour toutes réactions chimiques, un catalyseur facilite la combustion et comme cette dernière possède souvent une énergie d'activation élevée, l'usage d'un catalyseur permet de travailler à une température moins élevée. Ceci permet une combustion complète comme dans le cas des pots catalytiques qui grâce à la présence de métaux catalytiques brûlent les résidus des gaz d'échappement à une température inférieure à celle régnant dans le moteur.
Dans le cas des combustibles solides, l’énergie d’activation va permettre de vaporiser ou de pyrolyser le combustible. Les gaz, ainsi produits, vont se mélanger au comburant et donner le mélange combustible. Si l’énergie produite par la combustion est supérieure ou égale à l’énergie d’activation nécessaire, la réaction de combustion s’auto-entretient.
Énergie dégagée et pouvoir calorifique
La quantité d’énergie produite par la combustion est exprimée en joules (J) ; il s'agit de l'enthalpie de réaction. Dans les domaines d'application (fours, brûleurs, moteurs à combustion interne, lutte contre incendie), on utilise souvent la notion de pouvoir calorifique, qui est l'enthalpie de réaction par unité de masse de combustible ou l'énergie obtenue par la combustion d'un kilogramme de combustible, exprimée en général en kilojoule par kilogramme (noté kJ/kg ou kJ·kg-1).
Les combustions d'hydrocarbures dégagent de l'eau sous forme de vapeur. Cette vapeur d'eau contient une grande quantité d'énergie. Ce paramètre est donc pris en compte de manière spécifique pour l'évaluation du pouvoir calorifique, et l'on définit :
- le pouvoir calorifique supérieur (PCS) : « Quantité d'énergie dégagée par la combustion complète d'une unité de combustible, la vapeur d'eau étant supposée condensée et la chaleur récupérée »[2].
- le pouvoir calorifique inférieur (PCI) : « Quantité de chaleur dégagée par la combustion complète d'une unité de combustible, la vapeur d'eau étant supposée non condensée et la chaleur non récupérée »[3].
La différence entre le PCI et le PCS est la chaleur latente de vaporisation de l’eau (Lv) multipliée par la quantité de vapeur produite (m), qui vaut à peu-près 2 250 kJ·kg-1 (cette dernière valeur dépend de la pression et de la température).
On a la relation PCS = PCI + m·Lv.
Article détaillé : Pouvoir calorifique.Vitesse du front de flamme et explosion
Article détaillé : explosion.Dans le cas d'une flamme de prémélange, la combustion est caractérisée par la vitesse du front de flamme :
- La déflagration : la vitesse du front de flamme est inférieure à la vitesse du son (330 m/s sous une pression de 1 atm à 20 °C) ;
- La détonation : la vitesse du front de flamme est supérieure à la vitesse du son, et peut atteindre plusieurs kilomètres par seconde.
Feux de métaux
L'oxydation des métaux est en général lente. La chaleur dégagée est donc faible et est lentement dissipée dans l'environnement ; c'est le domaine de la corrosion (par exemple la rouille du fer et de l'acier).
Cependant, dans certains cas, l'oxydation est violente et constitue donc une combustion. Il existe cinq cas notables :
- combustion dans l'air du magnésium : le magnésium brûle facilement, en émettant une lumière très vive et blanche ; il était utilisé auparavant pour les flashs photographiques ;
- combustion du sodium dans l'eau : ce n'est pas à proprement parler le sodium qui brûle ; le sodium réagit violemment avec l'eau et provoque un dégagement de dihydrogène, et avec la chaleur produite par la réaction, le dihydrogène s'enflamme dans l'air ;
- aluminothermie : le comburant est ici un oxyde métallique, il s'agit d'une réaction chimique entre deux solides ;
- combustion à haute température et forte concentration de dioxygène : lorsque le métal est chauffé très fort et que l'on envoie du dioxygène pur, la réaction est suffisamment rapide pour s'auto-entretenir ; ce phénomène est utilisé pour l'oxycoupage au chalumeau, la lance thermique, et c'est aussi l'accident du « coup de feu » qui peut survenir avec un détendeur d'une bouteille de dioxygène (par exemple oxygène médical ou bouteille de chalumeau) ;
- combustion d'un métal sous forme de poudre ou de mousse : la réaction chimique se fait au contact entre le métal et l'air, or dans le cas d'une mousse ou d'une poudre, cette surface de contact (la surface spécifique) est très grande, la réaction est donc rapide et la chaleur dégagée importante ; c'est un phénomène comparable au coup de poussière.
Application en astronautique
La combustion est utilisée dans le domaine de l’astronautique pour fournir l’énergie de propulsion des engins spatiaux. Les termes correspondants en anglais sont burning et combustion.
Selon le type de combustion employée dans un propulseur, on parle de :
- Combustion en cigarette (en anglais cigarette burning et end burning) qui est une combustion d'un bloc de poudre caractérisée par une surface plane de combustion progressant dans la direction longitudinale, vers l'avant ou vers l'arrière ;
- Combustion érosive (en anglais erosive burning) qui est une combustion d'un bloc de poudre dans le cas où l'écoulement des gaz de combustion provoque une érosion du bloc ;
- Combustion transversale extérieure (en anglais external burning) qui est une combustion d'un bloc de poudre caractérisée par une surface de combustion s'étendant longitudinalement et progressant de l'extérieur vers l'intérieur ;
- Combustion transversale intérieure (en anglais internal burning) qui est une combustion d'un bloc de poudre qui s'effectue de l'intérieur vers l'extérieur à partir d'un canal central.
Notes et références
Droit français : arrêté du 20 février 1995 relatif à la terminologie des sciences et techniques spatiales. Les mots de la combustion, dictionnaire des termes couramment utilisés en combustion établi par le Groupement Français de Combustion
Voir aussi
Articles connexes
- Feu
- Flamme
- Réaction d'oxydo-réduction
- Explosion
- Chambre de combustion
- Pression de combustion
- Combustion du carbone (réaction chimique)
- Combustion spontanée
- Gazéification
Liens externes
- Portail de la chimie
Catégorie : Combustion
Wikimedia Foundation. 2010.