- Energie d'activation
-
Énergie d'activation
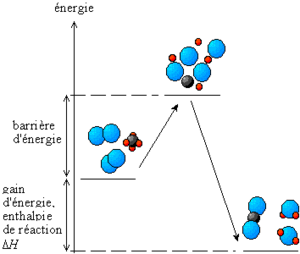
L'énergie d'activation est la quantité d'énergie nécessaire pour initier un processus chimique, le plus souvent une réaction. En effet, pour démarrer un processus, on doit souvent faire face à une barrière énergétique (c’est-à-dire apporter un minimum d'énergie pour le démarrage). Cette quantité est exprimée, selon le système international d'unités, en kJ/mol (kilojoules par mole de réactif).
Une explication simplifiée de cette barrière d'énergie peut être donnée par le mécanisme suivant.
Pour que deux molécules puissent réagir, il faut que leurs nuages électroniques puissent entrer en contact. Pour cela, il leur faut vaincre leur répulsion électrique. Ceci nécessite qu'elles se heurtent avec un élan suffisant. Cette énergie cinétique constitue l'énergie d'activation (représentant grossièrement l'énergie à fournir pour passer la "barrière d'énergie" à franchir dans la première partie du chemin sur le schéma de la réaction).
Cette énergie d'activation peut être diminuée, en utilisant un catalyseur.
Sommaire
Les deux sources de l'énergie d'activation
Extérieure
Se dit d'une énergie d'activation qui est extérieure au contact comburant / combustible.
Exemple : J'ai du papier dans l'air et il me faut apporter de l'énergie (une flamme par exemple) pour que la combustion s'amorce.
Induite
Se dit d'une énergie d'activation qui est induite par le contact comburant / combustible.
Exemple : J'ai un hydrocarbure (essence) et je le mets en contact avec de l'acide nitrique concentré (comburant). Le contact de l'un avec l'autre génère un dégagement de chaleur (énergie) qui est suffisamment importante pour amorcer la combustion (explosion).
C'est le principe des réactions incompatibles.
Voir aussi
- Portail de la chimie
Catégories : Thermochimie | Physico-chimie des interfaces | Catalyse
Wikimedia Foundation. 2010.