- Chlorure de Sodium
-
Chlorure de sodium
Chlorure de sodium 
Halite Général Nom IUPAC chlorure de sodium No CAS No EINECS PubChem SMILES InChI Apparence Poudre blanche ou cristaux cubiques transparents Propriétés chimiques Formule brute NaCl Masse molaire 58,443 g∙mol-1
Cl 60,66 %, Na 39,34 %,Propriétés physiques T° fusion 801 °C T° ébullition 1 465 °C Solubilité 35,9 g/100 cm3 d'eau pH 6,7-7,3
100g/L glycérineMasse volumique 2,17 g/cm³ à 20 °C Thermochimie S0gaz, 1 bar 229,79 J/mol·K S0liquide, 1 bar 95,06 J/mol·K S0solide 72,11 J/mol·K ΔfH0gaz -181,42 kJ/mol ΔfH0liquide -385,92 kJ/mol ΔfH0solide -411,12 kJ/mol Cristallographie Système cristallin Cubique Réseau de Bravais cF Précautions SIMDUT[1] Produit non contrôlé Inhalation Peut causer des irritations Peau Peut causer des irritations Yeux Peut causer des irritations Écotoxicologie DL50 rats par ingestion
3,75 +-0,43g/kgUnités du SI & CNTP, sauf indication contraire. Le chlorure de sodium est un composé chimique de formule NaCl. On l'appelle plus communément sel de table ou de cuisine, ou tout simplement sel dans le langage courant. C'est le principal produit dissout dans l'eau de mer ; on l'appelle alors sel marin.
On l'obtient :
- dans des marais salants par évaporation de l'eau de mer.
- dans des mines, par extraction du sel gemme (halite).
- en le synthétisant lors une réaction à hautes températures du dichlore (Cl2) et du sodium métallique.
Le chlorure de sodium est utilisé dans l'industrie chimique pour produire du chlore, de la soude caustique et de l’hydrogène.
Sommaire
Structure chimique
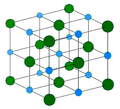
Le sel est un assemblage d'ions Na + et Cl − de maille cubique. Le sel est un cristal, car ses atomes forment une structure périodique et symétrique.
La structure du sel peut être décrite par le contenu de sa maille. Une maille de sel est un cube qui contient :
- un atome de chlore aux sommets de la maille (8 sommets chacun partagé parmi 8 mailles voisines)
- trois atomes de chlore au centre des faces de la maille (6 faces chacune partagée entre 2 mailles voisines)
- un atome de sodium au centre de la maille
- trois atomes sodium sur le milieu des arêtes de la maille (12 arêtes chacune partagée parmi 4 mailles voisines).
La structure du sel correspond au remplissage par les cations Na + d'une structure hôte composée par les anions Cl − . En effet, les anions Cl − forment un sous réseau cubique à faces centrées dans lequel les cations Na + occupent tous les sites octaédriques de la maille. Dans la structure du sel, les ions Na + et Cl − sont interchangeables. Il est aussi possible de dire que les cations Na + forment un sous réseau cubique à face centrée dans lequel les anions Cl − occupent tous les sites octaédriques de la maille.
La structure NaCl correspond à deux sous réseaux cubiques à face centrée d'ions, décalés de la moitié du coté de la maille selon l'une des directions des cotés de la maille.
La coordinence est le nombre de plus proches atomes voisins dans la structure. Tous les ions Na + et Cl − ont chacun dans le sel une coordinence 6, c'est-à-dire que n'importe quel ion Cl − est entouré de 6 ions Na + formant un octaèdre autour du Cl − . Et vice versa, autour de chaque ion Na + se trouvent comme plus proches voisins 6 ions Cl − formant aussi un octaèdre.
Réserve naturelle
Le chlorure de sodium ou sel est disponible en quantité quasi-illimitée. En effet, il existe deux types de réserves : le sel gemme ou le sel dissout dans l'eau de mer. Les plus anciens dépôts de sel formés dans les océans sont évalués à plus de 600 millions d'années.
C'est l'un des plus abondants minéraux de la planète.
Les mers et océans sont les plus grosses réserves de sel dissoutes. Elles sont estimées à environ 50×1015 tonnes. L'eau de mer contient environ 30 à 40 grammes de sel par litre d'eau, ce qui représente une hauteur de 75 mètres répartie sur les 3/4 de la surface du globe.
Extraction du sel
Il existe plusieurs façons de récupérer le chlorure de sodium. Dans les pays où l'ensoleillement et les températures sont suffisantes, le sel peut être extrait par évaporation grâce au système des marais salants. Une série de bassins peu profonds permettent de favoriser l'évaporation de l'eau. Le sel est de plus en plus concentré au fur et à mesure du passage de l'eau de mer dans les bassins. Dans les derniers bassins, le sel sédimente et peut être récolté par raclage.
Dans les pays froids, le système de congélation est utilisé. L'eau de mer est congelée et le sel sédimente dans la saumure de plus en plus concentrée. Lorsque la concentration est suffisante, le sel finit par précipiter.
Pour l'halite, le sel est extrait comme un minerai dans une mine souterraine si la couche est suffisamment épaisse. Mais dans la plupart des cas, le sel est mélangé ou la couche est trop fine. Aussi, pour l'extraire, de l'eau est injectée et la solution de sel est pompée à la surface.
Importance biologique
Dans notre organisme, les ions Na+ jouent un rôle important dans la transmission du flux nerveux. Le sel contribue aussi au maintien d'un milieu osmotique favorable pour les cellules et évite la déshydratation.
Risques cardio-vasculaires associés à une surconsommation sodée
En trop grande dose, le sel contribue à augmenter la tension artérielle. Un apport de 2 g par jour serait suffisant, mais la consommation est en général très supérieure à ce minimum (9 à 10 g/jour en moyenne en 2001 en France).
L’Agence française de sécurité sanitaire des aliments (AFSSA) a recommandé (janvier 2002) de réduire de 20 % en 5 ans l’apport en sel dans l’alimentation, pour limiter l’apport moyen en sel à 7 à 8 g/jour et par habitant, contre 9 à 10 g/jour en moyenne [2], voire beaucoup plus : 15% de la population française consomment plus de 15 grammes de sel par jour (sel de table et sel déjà contenu dans les aliments)[3]. À noter que la part la plus importante des apports sodés dans les pays développés se trouve dans les aliments préparés ce qui rend indispensable la collaboration de l'industrie alimentaire pour essayer d'en réduire la teneur en sel[4].
Actuellement en France, l'excès de sel serait responsable, selon les travaux du professeur Pierre Méneton, chercheur à l’Inserm, de 25 000 décès par an en France et de 75 000 accidents cardiovasculaires, par hypertension[5]. Ce constat et sa connexion avec les pratiques de l'industrie agroalimentaire lui valurent un procès en diffamation de la part du Comité des Salines de France[6], où il fut relaxé[7].
Études interventionnelles
La plupart des études démontrant une relation inverse entre la quantité de sel ingéré et la fréquence des maladies cardio-vasculaires sont de type observationnel : seul est noté la consommation en chlorure de sodium des sujets étudiés sans essayer de modifier le comportement alimentaire de ces derniers.
Les études interventionnelles sont plus rares mais tendent à démontrer le bénéfice à réduire l'apport sodé : en Finlande, les professionnels sont passés avec succès à un sel de substitution allégé en sodium et enrichi en potassium (chlorure de potassium) ; le rapport sodium/potassium alimentaire est en effet important[8]. Selon les travaux de chercheurs finlandais de l’université d’Helsinki et de Kuopo publiés dans la revue scientifique "Progress in Cardiovascular Diseases", une réduction de 30 à 35% des apports en sel dans leur pays, au cours des 30 dernières années, a largement contribué à la chute de plus de 75% de la mortalité cardiovasculaire chez les personnes de moins de 65 ans. Parallèlement l’espérance de vie des Finlandais a augmenté de 6 à 7 ans. Impressionnants bénéfices principalement dus à une baisse de plus de 1 point de la pression artérielle moyenne de la population[9]. De même, une réduction de près de 30% des maladies cardio-vasculaires a été observée dans une autre étude, et ce, de manière indépendante de la réduction des chiffres tensionnels[10].
Production et utilisations
Le sel est issu des marais salants, ou de l'extraction minière. Le sel industriel est obtenu par épuration et blanchiment, pour obtenir du sel blanc et pur à 99,9 %.
Les sels artisanaux issus des marais salants ne sont pas blanchis et ne subissent aucun traitement, ni ajout. Ils sont en partie commercialisés sous forme de « fleur de sel ».
Le sel à travers l'histoire
Le sel fut utilisé pendant le Moyen Âge pour le salage de la viande et il est encore utilisé dans ce but dans des pays en développement.
Utilisations biologiques, conservation
Le sel permet lors du salage et de la salaison de conserver les aliments, car lors de sa dissolution en ions Na+ et Cl-, la valeur Aw (ou teneur en eau libre) va baisser, la solution devient hypertonique. L'eau (une partie du moins) des cellules va alors être éjectée par osmose, provoquant la plasmolyse des cellules. Seules des moisissures de surface peuvent apparaître si le salage est insuffisant et si l'aliment n'est pas mis à l'abri de l'air et de la lumière. Le sel a une action bactériostatique à partir d'une concentration de 10 %, or avec l'évolution des préférences alimentaires, la concentration en sel est de l'ordre de 4 % dans les aliments, ce qui oblige à conserver les aliments au froid.
On utilise également le sel dans l'industrie pour conserver les peaux de bêtes en vue d'en faire du cuir, ou pour conserver les cornichons dans un mélange de vinaigre, de vin et de sel.
Agent de sapidité
Le chlorure de sodium permet d'augmenter la sapidité des aliments, les saveurs se font plus intenses grâce au sel. Les ions Na + stimulent les papilles gustatives tandis que les ions Cl − donnent le goût salé.
Additifs
Le sel permet de solubiliser les protéines dites salinosolubles. Cette propriété est utilisée pendant la fabrication du jambon de Paris. Les morceaux de jambon sont mélangés à une saumure (mélange d'eau et de sel). Les protéines salinosolubles forment alors une masse visqueuse et collante, le limon.
Une fois que le limon est suffisamment abondant, les morceaux sont réunis et cuits ensemble dans un moule pour donner la forme au produit. Le limon sert alors de colle entre les blocs qui, à la cuisson, donne une gélatine translucide, visible à la coupe. Les produits alimentaires a base de viande contiennent environ 4% de sel.
Salage des routes en hiver
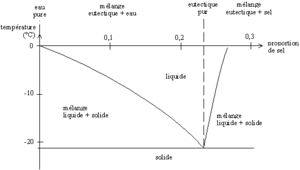
Le sel qui est utilisé pour saler les routes est un sel grossier. La température de solidification de l'eau salée dépend de la concentration en sel de la solution. Elle est minimale (environ -20 °C) pour une proportion de sel d'environ 20%, ce minimum correspond au mélange dit « eutectique ».
Pour que le chlorure de sodium (solide) puisse se dissoudre (dans un liquide), il faut suffisamment d'énergie pour casser les liaisons électrostatiques qui maintiennent les ions Na+ et Cl- dans la forme solide. C'est une réaction chimique endothermique (3900 joules sont nécessaires par mole de sel pour le dissoudre).
Lorsqu'on met du sel dans de la neige, celui-ci va se dissoudre en puisant un peu d'énergie dans la neige, qui devient plus froide (la dissolution du sel est endothermique). Le chlorure de sodium s'associe alors avec de la glace pour former un mélange d'eau salée (la glace en présence de sel n'est plus stable, elle fond pour former un mélange, voir les propriétés colligatives qui expliquent pourquoi la glace fond en présence de sel: simplement la glace fond en présence de sel mais pour fondre elle a besoin d'énergie (chaleur latente de fusion) qu'elle préleve du mélange qui se refroidit (principe des mélanges réfrigérant)) possédant des propriétés différentes de l'eau pure : la température nécessaire pour que de la glace subsiste devient donc inférieure à 0 °C et est proportionnelle à la quantité de sel dissous (jusqu'a -21 °C pour 23% de sel en masse).
Séparation de l'huile essentielle
Le chlorure de sodium est utilisé pour faciliter la séparation de l'huile essentielle lors de son extraction (procédé appelé relargage).
Étymologie
Autres faits
Les étiquettes donnent le sodium, rarement le sel; il est bon de savoir que :
2,54 Sodium = chlorure de sodium = Sel
Notes et références
- ↑ « Chlorure de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Sel et politique de Santé Publique. Les recommandations du Groupe de Travail « Sel » de l’AFSSA
- ↑ L’addiction par le sel
- ↑ FP Cappuccio, Salt and cardiovascular disease, BMJ 2007;334:859-860
- ↑ Le sel amer
- ↑ Un chercheur attaqué par l'industrie du sel (interview de Pierre Meneton), septembre 2007, LaNutrition.fr
- ↑ Poursuivi pour avoir accusé les producteurs de sel de désinformation, un chercheur de l'Inserm a été relaxé, mars 2008, LeMonde.fr
- ↑ Ce qu’il faut savoir sur les régimes et les maladies cardiovasculaires
- ↑ "Les méfaits du sel confirmés", Le Point, 9 novembre 2006
- ↑ Cook NR, Cutler JA, Obarzanek E, Buring JE, Rexrode KM, Kumanyika SK, et al. Long term effects of dietary sodium reduction on cardiovascular disease outcomes: observational follow-up of trials of hypertension prevention. BMJ 2007;334;885
Voir aussi
Articles connexes
Liens externes
- (en) Salt Institute website
- (en) Salt Archive website
- (en) Hazardous Chemical Database
- Portail de la chimie
- Portail de l’alimentation et de la gastronomie
Catégories : Composé du sodium | Chlorure de sodium | Saveur salée
Wikimedia Foundation. 2010.