- Eau De Mer
-
Eau de mer
L’eau de mer est l'eau salée des mers et des océans de la Terre. « Salée » désigne le fait qu'elle contient des substances dissoutes, les sels, principalement du chlore et du sodium. On trouve 30 à 40 grammes de sels dissous pour un kilogramme d'eau de mer. L'eau salée s'oppose à l'eau douce, qui contient moins d'un gramme de matériaux dissous par kilogramme. La masse volumique de l'eau de mer à la surface est d'environ 1,025 g/ml, supérieure de 2,5 % à celle de l'eau douce(1 g/ml) à cause de la masse du sel et de l'électrostriction[2].
Les océans et mers occupent un volume estimé à 1 340 millions de km³, ce qui représente 96,4 % de la capacité des grands réservoirs d'eau à la surface de la Terre. Ce volume n'inclut pas les eaux souterraines (aquifères), dont 85 % en volume sont salées à différents degrés[réf. nécessaire].
Sommaire
Origine du sel de l'eau de mer
Les premières théories scientifiques sur l'origine du sel de la mer datent de Edmond Halley qui propose en 1715 que le sel et les autres minéraux y sont amenés par les rivières[3] : l'écoulement de l'eau en surface (eau de pluie) et dans les rivières « arrache » des ions par dissolution des roches. Les eaux douces souterraines et de surface sont donc très légèrement « salées » à cause de ces ions ; ces ions sont entrainés jusqu'à l'océan, où ils restent tandis que l'évaporation entraine leur concentration (voir le cycle de l'eau). Halley note que les quelques lacs qui ne débouchent pas sur un océan (comme la mer Morte et la mer Caspienne, voir Endoréisme) ont en général une salinité très élevée, ce qu'il appelle la « météorisation continentale » (continental weathering).
La théorie de Halley est en grande partie correcte. En plus du phénomène décrit ci-dessus, le sodium a été arraché au plancher océanique lors de la formation initiale des océans. La présence de l'autre ion dominant du sel, l'ion chlorure, provient du « dégazage » du chlorure d'hydrogène (sous la forme d'acide chlorhydrique) ainsi que d'autres gaz de l'intérieur de la Terre, via les volcans et les monts hydrothermaux. Les ions sodium et chlorure sont ensuite devenus les constituants majeurs du sel de mer.
La salinité moyenne des océans est stable depuis plusieurs milliards d'années, le plus probablement grâce à un processus tectonique et chimique qui enlève autant de sel qu'il n'en arrive par les rivières. Les ions chlorure et sodium sont ainsi enlevés par les dépôts d'évaporite (les « roches salines »), la « grésification » (le dépôt de sels dans l'eau interstitielle) et les réactions chimiques avec le basalte des fonds marins[4]. Depuis la création des océans, le sodium n'est plus arraché au fonds des océans, mais capturé dans les couches de sédiments couvrant les fonds marins. D'autres théories affirment que la tectonique des plaques entraine une partie du sel sous les masses continentales, où il remonte lentement à la surface.
Caractéristiques
Composition
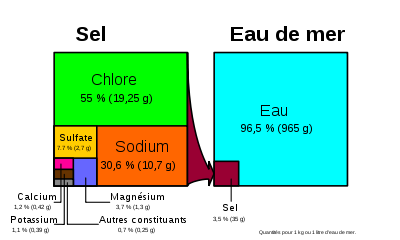
Principaux sels dissous pour une eau de mer de salinité 35 g/L[5] Anions g/kg mol/kg Chlore (Cl-) 19,3524 0,54586 Sulfate (SO42-) 2,7123 0,02824 Bicarbonate (HCO3-) 0,1080 0,00177 Brome (Br-) 0,0673 0,00084 Carbonate (CO32-) 0,0156 0,00026 Fluor (F-) 0,0013 0,00007 Hydroxyde (OH-) 0,0002 0,00001 Cations g/kg mol/kg Sodium (Na+) 10,7837 0,46906 Magnésium (Mg2+) 1,2837 0,05282 Calcium (Ca2+) 0,4121 0,01028 Potassium (K+) 0,3991 0,01021 Strontium (Sr2+) 0,0079 0,00009 Autres molécules g/kg mol/kg Eau (H2O) 965 53,6 Acide borique (B(OH)3) 0,0198 0,00032 Tetrahydroxyborate (B(OH)4-) 0,0079 0,00010 CO2* 0,0004 0,00001 L'eau de mer est composée d'eau et de sels, ainsi que de diverses substances en faible quantité. Si plus des deux tiers des 94 éléments chimiques naturels sont présents dans l'eau de mer, la plupart le sont en faible quantité et difficilement décelables.
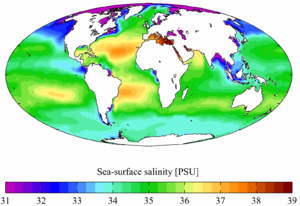
La salinité est un des paramètres les plus importants de l'eau de mer, et désigne la teneur en sels dissous. La salinité moyenne des océans est de 35 g/l, et reste généralement comprise entre 30 g/l (Atlantique nord) et 40 g/l (mer Rouge)[6]. Les mers intérieures ou assimilées ont une salinité supérieure, parce que l'évaporation y concentre le sel. Les exceptions concernent donc des mers fermées ou semi-fermées, comme pour les valeurs extrêmes de 6 g/l dans les eaux de surface de la mer Baltique et 330 g/l dans la mer Morte. La mer ouverte la plus salée est la mer Rouge.
La grande particularité de l'eau de mer est que les proportions relatives de ses constituants sont sensiblement constantes (c'est-à-dire indépendantes de la salinité) ; cette propriété a été établie par le chimiste écossais William Dittmar, et permet de considérer l'eau de mer comme une solution de onze constituants majeurs dans de l'eau pure, à savoir, par ordre décroissant d'importance, le chlore, le sodium, le magnésium, le sulfate, le calcium, le potassium, le bicarbonate, le brome, l'acide borique, le carbonate et le fluor. La loi de Dittmar permet ainsi de déterminer la salinité de l'eau de mer par une seule mesure : de la concentration d'un de ces constituants (par exemple, Cl-) ou d'une des propriétés physiques de l'eau de mer à une température donnée (comme la densité relative, l'indice de réfraction ou la conductivité).
Les deux principaux sels sont Na+ et Cl-, qui en s'associant forment le chlorure de sodium ou « sel marin », que l'on extrait dans les marais salants pour obtenir du sel alimentaire.
Les gaz dissous comprennent principalement : 64% d'azote, 34% d'oxygène, 1,8% de dioxyde de carbone (soit 60 fois la proportion de ce gaz dans l'atmosphère terrestre).
Composition de l'eau de mer
Pourcentage en masse des principaux élémentsÉlément Masse Élément Masse Oxygène (O) 85,84 Soufre (S) 0,091 Hydrogène (H) 10,82 Calcium (Ca) 0,04 Chlore (Cl) 1,94 Potassium (K) 0,04 Sodium (Na) 1,08 Brome (Br) 0,0067 Magnésium (Mg) 0,1292 Carbone (C) 0,0028 Indice de réfraction
La densité et donc l'indice de réfraction de l'eau de mer, noté n(λ), dépendent de la salinité. Les fonds marins (< 3 000 m) sont à une température inférieures à 4 °C (environ 2 °C ou moins) car l'eau salée voit son maximum de densité à une température inférieure, et surtout cet extremum s'estompe en un plateau constant avant la congélation[7].
Le mouvement des masses océaniques profondes est dominé par la variation de leur salinité. Elles proviennent principalement de la saumure issue de la formation de la banquise (congélation de l'eau de mer) en hiver aux pôles, ainsi que du refroidissement des eaux de surfaces dans les mêmes conditions. Le tableau ci-dessous montre comment le n(λ) augmente avec la salinité pour les D-lignes de sodium (moyenne : 5 893 angstroms = 589,3 nm) à 18 °C.
Changements de l'indice de réfraction dû à la salinité[7] salinité (g/kg) variation de n(λ) Emplacement 5 0,00097 Mers baltiques nordiques 10 0,00194 15 0,00290 20 0,00386 Enfoncements du Biafra 25 0,00482 30 0,00577 35 0,00673 Surface de l'océan Atlantique 40 0,00769 Mers rouges nordiques L'indice de réfraction est également une fonction de la pression de l'eau, mais la dépendance est tout à fait faible en raison de l'incompressibilité relative de l'eau (comme tous les liquides). En fait, sur les gammes normales des températures (0 - 30 °C), l'augmentation approximative du n(λ) est 0,000016 quand la pression de l'eau augmente d'une atmosphère.
Les facteurs les plus significatifs affectant le n(λ) sont la longueur d'onde de la lumière et la salinité de l'eau. Néanmoins, le n(λ) excède de moins de 1 % la gamme indiquée des valeurs de ces variables[7].
Autres caractéristiques
La masse volumique de l'eau de mer en surface varie de 1 020 à 1 029 kg/m³, selon la température et la salinité. En profondeur, dans les océans, la haute pression peut augmenter la masse volumique jusqu'à des valeurs de l'ordre de 1 050 kg/m³ (l'eau de mer, comme la plupart des liquides, est quasiment incompressible). Le pH varie entre 7,5 et 8,4, pour une moyenne de l'ordre de 8,2.
La vitesse du son dans l'eau varie avec la température de l'eau et la pression, elle est donc sensible aux thermoclines ; elle est de l'ordre de 1 500 m/s.
Potabilité
L'eau de mer n'est pas potable, et en général ne doit pas être bue par les êtres humains. Le sel en est le responsable : si l'on boit de l'eau de mer, à long terme la quantité d'eau nécessaire pour éliminer ces sels (grâce aux reins) devient supérieure à la quantité d'eau gagnée par absorption d'eau de mer[8]. La non-potabilité de l'eau de mer explique que, sur un navire ou une île au milieu de l'océan, on puisse « manquer d'eau », comme le dit La Complainte du vieux marin :
- « L’eau, l’eau partout,
- Et pas une goutte à boire. »
Si la consommation accidentelle de petites quantités d'eau de mer n'est pas dommageable pour le corps humain, il n'est pas possible de survivre à long terme en buvant uniquement de l'eau de mer. Cette croyance a pour origine la traversée de l'Atlantique d'Alain Bombard, mais qui utilisait aussi la chair des poissons et l'eau de pluie. Ainsi, le médecin allemand Hannes Lindemann qui avait voulu réitérer le voyage de Bombard avait montré qu'il n'était pas possible de se passer d'eau douce additionnelle[9]. L'OMS a utilisé ses travaux pour ses recommandations.
Le taux de chlorure de sodium dans le sang humain et dans l'urine se situe généralement autour de neuf grammes par litre (0,9 % en masse), un taux qui varie peu. Boire de l'eau de mer (dont le taux de sel est de 3,5 %) accroit temporairement la concentration de sel dans le sang. Ce sel doit être éliminé, ce qui se fait en utilisant de l'eau provenant de cellules pour uriner. Les cellules finissent par mourir de déshydratation, suivies par les organes et finalement le corps entier.
L'effet de l'absorption d'eau de mer a été étudiée sur rats en laboratoire[10], en faisant varier la concentration d'eau de mer dans leur eau de boisson. Au fur et à mesure que cette concentration augmentait, les rats devaient boire de plus en plus pour uriner davantage, jusqu'à une concentration de 50 %, tandis que leur soif déclinait après 50 %. Ces chercheurs recommandent ainsi de ne pas passer brutalement d'une consommation d'eau douce à une consommation d'eau de mer (pour des naufragés par exemple), mais plutôt d'augmenter progressivement la proportion d'eau de mer dans l'eau douce.
Les manuels de survie conseillent en général de ne pas boire d'eau de mer. Par exemple, le Medical Aspects of Harsh Environments (« Aspects médicaux des environnements hostiles »)[11] présente une analyse de 136 voyages en embarcation de sauvetage. Le risque de décès s'élevait à 39 % pour ceux qui buvaient de l'eau de mer, contre 3 % pour ceux qui n'en buvaient pas.
Pour rendre l'eau de mer potable (processus de dessalement), plusieurs techniques existent. La plus simple est de la diluer avec de l'eau potable jusqu'à ce que la salinité soit acceptable ; on utilise cette technique en agriculture, pour l'irrigation. Les techniques plus complexes, mises en œuvre notamment sur les grands navires, incluent les évaporateurs à vide, les évaporateurs « flash » ou l'osmose inverse.
Anecdotes
- À Hong Kong, plus de 90 % de l'eau pour les toilettes provient de la mer, ce qui l'oblige à un traitement différent[réf. nécessaire].
- René Quinton, un scientifique autodidacte, découvrit la similitude de notre milieu intérieur et de l'eau de mer. Il acquit en 1906 une célébrité mondiale en sauvant, par l'injection d'eau de mer isotonique, des milliers d'enfants atteints du choléra et il montra que la transfusion d'eau de mer pouvait remplacer la transfusion sanguine[réf. nécessaire].
Citations
« La mer est salée parce qu'il y a des morues dedans. Et si elle ne déborde pas, c'est parce que la providence, dans sa sagesse, y a placé aussi des éponges » — Alphonse Allais (Citation humoristique)
Sources
Références générales
- L. W. Tilton et J. K. Taylor, « Refractive index and dispersion of distilled water for visible radiation, at temperatures 0 to 60 °C », dans J. Res. Nat. Bur. Stand., Vol. 20, p. 419 (RP1085) 1938.
- E. Dorsey, Properties of Ordinary Water Substance in all of its Phases: Water-vapor, Water, and all the Ices, Reinhold Publishing, 1940.
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Seawater ».
Notes
- ↑ Données du World Ocean Atlas, 2001 [lire en ligne].
- ↑ Iver Duedall, Notes de cours - Océanographie, Florida Institute of Technology [lire en ligne].
- ↑ E. Halley, A short account of the cause of the saltiness of the ocean, and of the several lakes that emit no rivers; with a proposal, by help thereof, to discover the age of the world, Philosophical Transactions of the Royal Society of London, 29:296—300, 1715.
- ↑ Paul R. Pinet, Invitation to Oceanography, St. Paul: West Publishing Company, 1996 (ISBN 978-0763740795), p. 133.
- ↑ UNESCO, Tables océanographiques internationales, citées par Andrew W.Dickson et Catherine Goyet (éds.), Handbooks of methods for the analysis of the various parameters of the carbon dioxide system in sea water, US Department of Energy, version 2, septembre 1994, ORNL/CDIAC-74, chapitre 5, partie 6.1 « The major ion composition of seawater », p. V-10 [lire en ligne]
- ↑ La salinité de l'océan
- ↑ a , b et c E. Dorsey, Properties of Ordinary Water Substance in all of its Phases: Water-vapor, Water, and all the Ices, Reinhold Publishing, 1940.
- ↑ Ask A Scientist - Biology Archive lien
- ↑ Von Ulli Kulke, Durst löschen mit Salzwasser, Spiegel, 16 février 2006 [lire en ligne]
- ↑ Z. Etzion et R. Yagil, Metabolic effects in rats drinking increasing concentrations of sea-water, Comp Biochem Physiol A. 1987;86(1):49-55 [lire en ligne]
- ↑ Medical Aspects of Harsh Environments, chapitre 29 « Shipboard Medicine » [lire en ligne]
Voir aussi
Articles connexes
Liens externes
- Portail de l’eau
- Portail du monde maritime
Catégories : Eau à l'état liquide | Océanographie | Solution en biologie
Wikimedia Foundation. 2010.