- Salinite
-
Salinité
L'eau est un puissant solvant pour de nombreux minéraux. La salinité désigne la quantité de sels dissous dans un liquide.
Sommaire
Propriétés chimiques
Le sel dissous modifie les propriétés de l'eau, en premier lieu sa capacité de dissolution, sa densité, mais aussi sa compressibilité, son point de congélation et d'ébullition, sa conductivité électrique, sa dureté ainsi que sa viscosité ou sa corrosivité, et très légèrement sa capacité à transporter les sons et la lumière. La quantité de sels dissous dans un liquide modifie la pression osmotique de celui-ci.
Saturation
La salinité est limitée à une température donnée dit seuil de saturation, au delà duquel le liquide ne pouvant dissoudre plus de sel, des cristaux se forment au fond du récipient ou en périphérie de la surface). L'eau chaude peut contenir plus de sel dissous que l'eau froide.
Attention à ne pas confondre avec la dureté de l'eau qui est relative à son dosage en calcium et magnésium.
Mesure de salinité
La salinité est difficilement estimable par analyse chimique directe, c’est-à-dire par séchage et pesée du résidu solide, car certains corps présents (chlorures) s'évaporent en fin de séchage. Sachant que les proportions des constituants principaux de l'eau de mer sont quasiment constantes, le seul dosage de l'un d'entre eux peut donner la teneur de tous les autres, et une mesure de la salinité. Les ions chlore, brome et iode sont facilement dosables, par exemple par précipitation permettant un titrage au nitrate d'argent. Ils suffisent aux analyses. Ceci ne vaut pas pour les zones situées à proximité des pôles ou des estuaires, en aval d'usines de dessalement, de sources marines d'eau douce de remontées d'eaux salines d'origine volcanique.
La salinité est depuis 1978 officiellement mesurée à partir de la conductivité électrique de l'eau à une certaine température et pression. La salinité (S) d'un échantillon d'eau est donnée par le rapport K de la conductivité électrique de cet échantillon d'eau de mer à 15 °C et à la pression atmosphérique normale, avec la conductivité d'une solution de chlorure de potassium dans laquelle la fraction en masse de KCl est 0,0324356, à la même température et même pression. Si K = 1 la salinité est de 35. la salinité n'est plus présentée comme un rapport de masse. Elle s'exprime sans unité, comme le pH, mais on trouve encore des salinités exprimées en o/oo, en g/kg ou en psu (practical salinity unit).
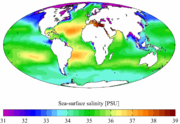
Salinité des océans
L'eau des océans est une solution qui contient en moyenne 35 g/kg de sels divers (chlorure de sodium essentiellement), avec un pH très stable de 8,2 (légèrement alcalin), mais qui tend à s'acidifier en solubilisant le CO2 anthropique en excès dans l'air. La Mer Morte contient beaucoup plus de sels, ce qui explique qu'on y flotte sans effort, alors que la Mer Baltique en contient beaucoup moins, ce qui explique qu'elle gèle plus vite. Néanmoins, hormis dans les mers fermées, on a montré au début du XXe siècle que la proportion des composants les plus importants reste quasi-constante, ce qui laisse penser que depuis des millions d'années et plus sans doute, les océans ont été parfaitement mélangés par la circulation thermohaline, avec l'aide de certaines espèces de plancton qui par leur mouvement quotidiens et saisonniers contribuent à homogénéiser les couches thermiques et salines.
Ceci indiquait qu'en plus des circulations particulières à chaque océan, l'eau circulait entre les différents océans, ce qui a été confirmé par la courantologie.
Quantités : Le volume des océans est estimé à 1 370 millions de km3. Il contiendrait donc environ 48 millions de milliards de tonnes de sels (ou 95 t/m² si on étalait ce sel sur le globe entier, ou encore 320 t/m² si on ne l'étalait que sur les parties actuellement émergées).
Principaux sels dissous pour une eau de mer de salinité 35 gr/kg Anions (en g/kg) Cations (en g/kg) Chlore (Cl-) 18,9799 Sodium (Na+) 10,5561 Sulfate (SO4--) 2,6486 Magnésium (Mg++) 1,2720 Bicarbonate (HCO3-) 0,1397 Calcium (Ca++) 0,4001 Brome (Br-) 0,0646 Potassium (K+) 0,3800 Fluor (F-) 0,0013 Strontium (Sr++) 0,0135 Salinité et climat
Une eau très salée est plus dense et "coule" ou plonge sous une eau moins dense. C'est ainsi que dans les régions polaires le sel est rejeté lorsque l'eau de mer se transforme en glace qui expulse le sel qui enrichit alors donc l'eau liquide la rendant encore plus dense et la faisant plonger vers les grands fonds marins, alimentant la circulation thermohaline, qui joue un rôle important dans la régulation climatique, le mélange des couches océaniques et l'écologie planétaire.
Mais en l'absence de source d'eau dense dans le Pacifique l'eau de fond remonte progressivement de par une diminution progressive de sa densité.
Voir aussi
Liens externes
- Portail de la chimie
- Portail du monde maritime
- Portail de l’écologie
Catégories : Sel | Océanographie | Chlorure de sodium
Wikimedia Foundation. 2010.