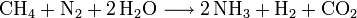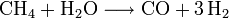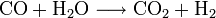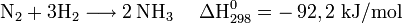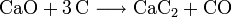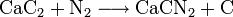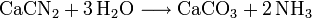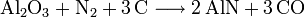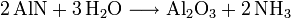- 7664-41-7
-
Ammoniac
Ammoniac 
Structure de l'ammoniac Général Nom IUPAC ammoniac Synonymes azane
nitrure d'hydrogène
esprit alcalin (volatil)[1]No CAS No EINECS SMILES InChI Apparence gaz comprime liquefie, incolore, d'odeur acre.[2] Propriétés chimiques Formule brute NH3 Masse molaire 17,0305 g∙mol-1
H 17,76 %, N 82,25 %,Propriétés physiques T° fusion -78 °C[2] T° ébullition -33 °C[2] Solubilité dans l'eau à 20 °C : 54 g/100 ml[2] Masse volumique (eau = 1) : 0.7 à -33 °C[2],
0,6813 (gaz)T° d’auto-inflammation 651 °C[2] Limites d’explosivité dans l’air Inférieure : 15,5 (Weiss, 1985)
Supérieure : 27 (Weiss, 1985)Pression de vapeur saturante à 26 °C : 1013 kPa[2] Thermochimie S0gaz, 1 bar 192,77 J/mol·K ΔfH0gaz -45,9 kJ/mol ΔfH0liquide -40,2 kJ/mol Précautions Directive 67/548/EEC 
T
NPhrases R : 10, 23, 34, 50, Phrases S : 1/2, 9, 16, 26, 36/37/39, 46, 61, [3] Transport - 1005 NFPA 704 SIMDUT[4] 



SGH[5] 



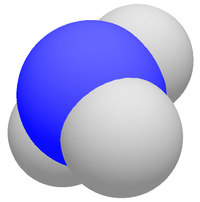
DangerInhalation Les vapeurs sont très irritantes et corrosives Peau Les solutions concentrées peuvent provoquer des brûlures Yeux Dangereux, Irritation Ingestion L'ingestion peut provoquer des brûlures de la bouche, langue, œsophage Unités du SI & CNTP, sauf indication contraire. L’ammoniac est un composé chimique, de formule NH3 (groupe générique des nitrures d'hydrogène). C'est une molécule pyramidale à base trigonale : l'atome d'azote (N) est au sommet et les trois atomes d'hydrogène (H) occupent les trois coins (sommets) de la base triangulaire équilatérale.
En réalité, l'atome d'azote vibre entre cette position « au sommet » de la pyramide, et du sommet opposé. Traversant ainsi la base triangulaire des hydrogène selon une fréquence fondamentale de 24 GHz. Ce qui a été utilisé dans les premières horloges atomiques.Dans les conditions « ambiantes », il se présente sous la forme d'un gaz incolore (produisant une fumée de condensation à haute concentration) et dégageant une très désagréable odeur putride.
Sommaire
Nomenclature
D'après la nomenclature IUPAC, l'ammoniac est le plus simple des Azanes[6], ou hydrures d'azote acycliques.
Production industrielle
La production industrielle de l'ammoniac se fait essentiellement par synthèse directe à partir de dihydrogène et de diazote (procédé Haber-Bosch). Le diazote est fourni par l'air et le dihydrogène par vaporéformage du méthane (gaz naturel).
Qui peut se décomposer en :
- Production de dihydrogène par vaporéformage (voir l'article dihydrogène) :
- Synthèse de l'ammoniac :
Ancienne méthode de fabrication
Anciennement, l'ammoniac était obtenu par distillation du purin et du fumier.
Au début du XXe siècle, différents procédés de synthèse ont été imaginés.
L'un d'entre eux se base sur l'hydrolyse de la cyanamide calcique, elle-même obtenue à partir du carbure de calcium.L'autre utilise l'hydrolyse du nitrure d'aluminium, lui-même produit par nitruration à haute température de l'alumine.
Il faudra attendre 1913 pour voir apparaitre le procédé Haber-Bosch encore employé au XXIe siècle.
Propriétés physicochimiques
- Odeur : très âcre et facilement reconnaissable, nocif par inhalation (mortel à hautes doses).
- Inflammabilité et explosibilité : sous forte pression, l'ammoniac peut former un mélange explosif avec les huiles de lubrification, le mélange air-ammoniac s'enflamme et explose violemment.
- Surchauffe de compression : la valeur élevée du rapport α=Cp/Cv = 1,335 à 0 °C limite rapidement le taux de compression admissible du fait des hautes températures des vapeurs de refoulement, températures qui risqueraient au-delà d'une température de 120 °C une altération des huiles de lubrification et la formation d'un mélange détonant.
- Corrosion des métaux, joints et lubrifiants : attaque le cuivre et tous ses alliages. C'est la raison pour laquelle les installations frigorifiques fonctionnant à l'ammoniac sont réalisées avec des tuyauteries en acier.
- Miscibilité et solubilité : très soluble dans l'eau et non miscible avec les huiles naphténiques et les huiles de synthèse. Lorsqu'il est dissout dans l'eau, le gaz ammoniac forme une solution aqueuse de ce gaz, nommée l’ammoniaque, et donne lieu à un équilibre peu dissocié ; il se formerait alors de l'hydroxyde d'ammonium de formule NH4OH. L'ion ammonium NH4+ comporte alors un atome d'hydrogène aux quatre sommets du tétraèdre. L'existence de l'hydroxyde d'ammonium est remise en question, à cause de la qualité d'acide de Lewis de l'ion ammonium.[réf. nécessaire]
Utilisations
Sous forme gazeuse, l'ammoniac est utilisé par l'industrie pour la fabrication d'engrais, d'explosifs et de polymères. L'ammoniac gazeux, qui donne 82 % d'azote, sert aussi d'engrais azoté ; il est injecté directement dans le sol sous forme d'ammoniac liquéfié sous pression.
On le trouve aussi dans la cigarette. Les fabricants l'ajoutent à la préparation du tabac en raison de sa faculté à faciliter et augmenter l'absorption de la nicotine, composé addictif du tabac.
Réfrigération
L'ammoniac est utilisé comme fluide frigorigène et est désigné par la référence R717.
- La lettre R signifie réfrigérant.
- 7 : les fluides frigorigènes d'origine inorganique sont répertoriés dans la série des 700. Le chiffre des centaines est donc un 7.
- 17 : le chiffre des dizaines et celui des unités ici représentent la masse molaire de la molécule à savoir M(NH3)=17,0 g.mol-1.
Carburant
L'ammoniac est un vecteur énergétique car il permet de transporter de l'hydrogène sous une forme dont le stockage est relativement simple. Il brûle difficilement dans l'air mais la combustion est facilitée par une décomposition partielle par passage sur un catalyseur.
Pendant la Seconde Guerre mondiale, des véhicules (notamment des autocars en Belgique) ont fonctionné avec de l'ammoniac. Dans les années 1960, l'armée américaine s'y est intéressée dans le cadre du concept MED (Mobile Energy Depot) qui visait a produire directement les carburants sur le champ de bataille à partir de réacteurs nucléaires transportables.[réf. souhaitée]
Au XXIe siècle, l'ammoniac fait l'objet de nouvelles études pour des moteurs classiques sans émissions de CO2 et pour le fonctionnement de piles à combustible.
Détection des fuites
Du fait de son odeur particulière, une fuite d'ammoniac est facilement identifiable à l'odorat. Techniquement, on utilise une baguette soufrée, qui enflammée au voisinage d'émanation d'ammoniac produit une fumée blanche dense permettant ainsi de localiser l'origine de la fuite. La recherche de fuite sur une installation ammoniac ne peut se faire qu'à l'aide d'un ARI (appareil respiratoire individuel) du fait de sa très forte toxicité.
Phrases de risque et conseils de prudence selon l'INRS
Article détaillé : Signalisation des substances dangereuses.R10 – Inflammable.
R23 – Toxique par inhalation.
R34 – Provoque des brûlures.
R50 – Très toxique pour les organismes aquatiques.
S9 – Conserver le récipient dans un endroit bien ventilé.
S16 – Conserver à l’écart de toute flamme ou source d’étincelle. Ne pas fumer.
S26 – En cas de contact avec les yeux laver immédiatement et abondamment avec de l’eau et consulter un spécialiste.
S36/37/39 – Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux/du visage.
S45 – En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible lui montrer l’étiquette).
S61 – Ne pas rejeter dans l’environnement. Consulter les instructions spéciales / la fiche de données de sécurité.
Référence ONU pour le transport des matières dangereuses
- Classe 2
- Classe 8
- numéro 2672 (ammoniac en solution aqueuse de densité comprise entre 0,880 et 0,957 à 15 °C contenant plus de 10 % mais au maximum 35 % d'ammoniac)
Liens sécurité
Notes et références
- ↑ P.H.Nysten, Dictionnaire de médecine, de chirurgie, de pharmacie, des sciences accessoires et de l'art vétérinaire, Société typographique belge, 1840p.345
- ↑ a , b , c , d , e , f et g AMMONIAC (ANHYDRE), fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ ESIS. Consulté le 6 décembre 2008
- ↑ « Ammoniac » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Référence IUPAC
Voir aussi
Articles connexes
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique dangereux pour l'environnement | Produit chimique corrosif | Composé de l'azote | Composé de l'hydrogène | Amine | Réfrigérant | Produit chimique domestique | Métabolisme de l'azote | Engrais azoté
Wikimedia Foundation. 2010.