- C9H11NO3
-
Tyrosine
Tyrosine 
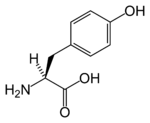
Structure de la tyrosine Général Nom IUPAC acide (S)-2-amino-3-(4-hydroxyphényl)propanoïque Synonymes Y, Tyr No CAS (racémique)
(L) ou S(-)
(D) ou RNo EINECS DrugBank PubChem ChEBI FEMA SMILES InChI Propriétés chimiques Formule brute C9H11NO3 [Isomères] Masse molaire 181,1885 g∙mol-1
C 59,66 %, H 6,12 %, N 7,73 %, O 26,49 %,pKa 2,2 [1] Propriétés physiques T° fusion 343 °C (décomposition) [1] Solubilité 479 mg∙l-1 (eau,25 °C) [1] Thermochimie S0solide 214,01 J∙mol-1∙K-1 [2] ΔfH0solide -685,6 kJ∙mol-1 [2] Cp 216,44 J∙mol-1∙K-1 (solide,25 °C)[2] Précautions SIMDUT[3] Produit non contrôlé Unités du SI & CNTP, sauf indication contraire. La tyrosine (Tyr ou Y) est un acide aminé aromatique, polaire.
Elle participe à la synthèse des catécholamines : l'adrénaline, la noradrénaline, la dopamine et la DOPA. Elle est aussi précurseur de la mélanine (pigment qui colore la peau, les poils, l'iris)et des hormones thyroïdiennes (formation de thyronine à partir de deux tyrosine).
Elle peut être synthétisée, dans le corps, à partir de la phénylalanine, sauf en cas de phénylcétonurie (maladie résultant d'une accumulation de phénylalanine dans le sang due à l'absence d'une protéine fonctionnelle: la phénylalanine hydroxylase). Elle est donc non indispensable, sauf en l'absence de phénylalanine.
Le noyau aromatique de la tyrosine (ou parahydroxy phénylalanine) comprend un groupement hydroxyl qui rend sa chaine latérale moins hydrophobe que celle de la phénylalanine (mais la tyrosine est un acide aminé nettement moins soluble dans l'eau que la phénylalanine). Cette fonction hydroxyle lui permet d'être phosphorylée par des enzymes appelés kinases. La phosphorylation d'un acide aminé a très souvent un rôle de régulation de l'activité de l'enzyme elle même. La thréonine et la sérine sont deux autres acides aminés pouvant subir la même phosphorylation.
La tyrosine peut également être modifiée en (3-)nitrotyrosine. Cette réaction de nitration peut affecter la tyrosine en tant qu'acide aminé libre ou que résidu d'acide aminé intégré dans une chaîne polypeptidique. In vivo, cette réaction est majoritairement due à l'action de l'acide péroxynitreux (ou péroxynitrite, ONOOH), mais d'autres voies réactionnelles peuvent également aboutir à la formation de nitrotyrosine. In vitro, le tétranitrométhane (TNM) a aussi été utilisé dans ce but. La nitration de tyrosines est généralement vue comme un phénomène pathologique (e.g. l'augmentation de la concentration plasmatique de nitrotyrosine est considérée comme un biomarqueur de phénomènes inflammatoires), bien que la possibilité que cette réaction soit également un phénomène physiologique ait récemment été suggérée.
Dans son assiette
De petites étoiles blanches sont visibles sur la tranche de section de certains fromage comme le Comté. Croquant sous la dent, des cristaux de tyrosine attestent de la protéolyse lors de la maturation. Cette tyrosine peu soluble dans l'eau se rassemble en fines cristallisations que savent apprécier les gourmets.
Liens externes
- http://www.chups.jussieu.fr/polys/biochimie/STbioch/POLY.Chp.11.19.html
- (en) http://www.chemie.fu-berlin.de/chemistry/bio/aminoacid/tyrosin_en.html
Références
- ↑ a , b et c (en) « Tyrosine » sur ChemIDplus, consulté le 8 juillet 2009
- ↑ a , b et c (en) « Tyrosine » sur NIST/WebBook, consulté le 8 juillet 2009
- ↑ « Tyrosine (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
Ala | Arg | Asn | Asp | Cys | Glu | Gln | Gly | His | Ile | Leu | Lys | Met | Phe | Pro | Ser | Thr | Trp | Tyr | Val Acide aminé essentiel | Protéine | Peptide | Code génétique - Portail de la biochimie
- Portail de la chimie
Catégorie : Acide aminé
Wikimedia Foundation. 2010.

