- 3-hydroxy-3-méthyl-glutaryl-CoA réductase
-
Cholestérol
Cholestérol 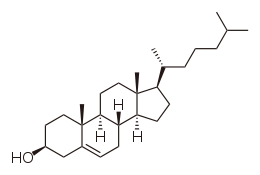
Structure du cholestérol Général Nom IUPAC 10,13-diméthyl-17-(6-méthylheptan-2-yl)-2,3,4,7,8,9,11,12,14,15,16,17-dodécahydro-1H-cyclopenta[a]phénanthren-3-ol No CAS No EINECS DrugBank PubChem SMILES InChI Apparence solide blanc Propriétés chimiques Formule brute C27H46O [Isomères] Masse molaire 386,6535 g∙mol-1
C 83,87 %, H 11,99 %, O 4,14 %,Propriétés physiques T° fusion 147 à 150 °C [1] T° ébullition 360°C (décomposition) [1] Solubilité pratiquement insoluble (eau)[1] Masse volumique 1,07 g/cm³ (20°C) [1] Point d’éclair 250°C [1] Précautions Classification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[2] Unités du SI & CNTP, sauf indication contraire. Le cholestérol est un lipide de la famille des stérols qui joue un rôle central dans de nombreux processus biochimiques. Le cholestérol tire son nom du grec ancien chole- (bile) et de stereos (solide), car il fut découvert sous forme solide dans les calculs biliaires en 1769 par François Poulletier de la Salle[3]. Mais ce n'est qu'en 1815 que le chimiste français Eugène Chevreul lui donna le nom de cholestérine.
Le mot « cholestérol » désigne une molécule et ne doit pas être confondu avec les termes de « bon » et « mauvais cholestérol» faisant référence aux HDL et LDL, les transporteurs du cholestérol dans le sang. Voir en particulier #Teneur en cholestérol dans l'alimentation
Sommaire
Structure
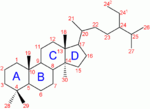
La molécule de cholestérol comprend quatre cycles carbonés noté A,B,C et D (noyau cyclo-pentano-phénanthrénique), 8 carbones asymétriques (les carbones 3, 8, 9, 10, 13, 14, 17 et 20), ce qui fait 28 soit 256 stéréoisomères dont un seul existe: le 3β-ol lévogyre. Le cholestérol possède un groupe hydroxyle -OH sur le carbone 3 (C3). Ce groupe chimique constitue la tête polaire. Ce groupement R-OH constitue donc la partie hydrophile du cholesterol. La fonction OH du cholestérol peut être estérifiée par un acide gras qui rend la molécule totalement insoluble dans l'eau.
Localisation
Le cholestérol est présent sous forme de stérides (cholestérol estérifié) dans la plupart des tissus des vertébrés, et en particulier le foie, le cerveau, et la moelle épinière.
Rôle
C'est un composant majeur des membranes cellulaires qui contribue à leur stabilité et au maintien de leurs structures en s'intercalant entre les phospholipides.
Le cholestérol est également un précurseur de nombreuses molécules :
- la vitamine D3 qui intervient dans la calcification des os,
- les hormones stéroïdes : cortisol, cortisone, et aldostérone,
- les hormones stéroïdes sexuelles : progestérone, œstrogènes, et testostérone,
- les acides biliaires, ...
Métabolisme
Synthèse
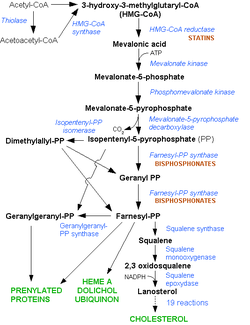
La synthèse du cholestérol se fait dans le cytoplasme des cellules du foie et de l'intestin principalement. La synthèse débute par la condensation de trois molécules d'acétate (=3×2 carbones) en hydroxy-méthyl-glutarate (ou HMG = 1×6 carbones). Cette synthèse est effectuée par l'hydroxyméthylglutaryl-Coenzyme A synthase (ou HMGCoA synthase), une enzyme, en présence de coenzyme A, un cofacteur d'enzyme. L'hydroxy-méthyl-glutarate est ensuite réduit en mévalonate (=1×6 carbones). Cette étape est régulée par les statines. Le mévalonate est ensuite décarboxylé en isoprènoïdes à 5 carbones (l'isopentényl pyrophosphate et le diméthylallyl pyrophosphate). La condensation de 6 molécules d’isoprènoïdes aboutit finalement au squalène (6×5=30 carbones). Enfin, le squalène subit l’action de la squalène cyclase qui créé les cycles du cholestérol à partir des insaturations présentes dans le squalène.
Régulation
Une partie du cholestérol peut ne pas être absorbée lors de la digestion ; On a découvert une bactérie intestinale présente chez l'homme qui transforme le cholestérol en coprostanol, stable et non absorbable et donc éliminée dans les selles[4].
Concernant le cholestérol absorbé ou produit par l'organisme, il existe trois niveaux de régulation du cholestérol, le but étant de diminuer le taux de cholestérol de la cellule quand il est en excès :
- Le cholestérol libre dans la cellule inhibe la production de ses propres récepteurs membranaires LDLR. Pour ce faire, il inhibe la transcription du gène qui code les LDLR. Par conséquent, le flux entrant de cholestérol dans la cellule est diminué.
- Le cholestérol libre inhibe la HMG-coA réductase, ce qui empêche la poursuite de la réaction de synthèse du cholestérol.
- Enfin, le cholestérol libre stimule l’acyl transférase (ACAT), enzyme catalysant son estérification en stéride. Ceci favorise le stockage du cholestérol libre.
La synthèse de mévalonate, deuxième étape de la synthèse du cholestérol, est très régulée par le métabolisme. L'activité de l'HMG-CoA réductase, enzyme catalysant cette synthèse, est diminuée lorsque l'apport alimentaire en cholestérol est élevé ou par des médicaments de la famille des statines. Environ un tiers du cholestérol provient de l'alimentation (viandes, œufs, abats, produits laitiers, etc.) tandis que les deux tiers restants sont synthétisés par l'organisme (dans le cas d'une alimentation équilibrée).
Dégradation
Le cholestérol est dégradé dans le foie en acides biliaires (dont l'acide chénodésoxycholique) par la 7-α-hydroxylase. La colestyramine[5], un médicament utilisé pour traiter l'hypercholestérolémie, diminue l'absorption intestinale des acides biliaires, et par conséquent leur concentration dans les cellules hépatiques. Ceci entraîne une activation de la 7-α-hydroxylase et favorisant la dégradation du cholestérol.
Transport du cholestérol dans le sang : LDL, VLDL et HDL
Étant un composé hydrophobe, le cholestérol n'est pas soluble dans le sang. Son transport est assuré par quatre types de lipoprotéines :
- Les lipoprotéines à basse densité (ou LDL : Low Density Lipoprotein) transportent le cholestérol des lieux de sécrétion vers les cellules de l'organisme. Des taux importants de LDL conduisent généralement au dépôt de cholestérol sur les parois des artères (les récepteurs à LDL du foie et des tissus sont en effet très sensibles : au moindre changement biochimique d'une LDL, du fait d'une oxydation ou dégradation liée à la fumée de cigarette ou à d'autres facteurs, les lipoprotéines transportant le cholestérol ne sont plus reconnues, et sont donc phagocytées, puis forment un dépôt) sous forme de plaque d'athérome, ce qui accroît le risque de maladies cardiovasculaires et leur vaut le nom de « mauvais » cholestérol ;
- Les lipoprotéines à haute densité (ou HDL : High Density Lipoprotein) déchargent les artères et les tissus extrahépatiques du cholestérol, et le ramènent vers le foie où il est dégradé ; on parle alors de « bon » cholestérol ;
- Les chylomicrons, ces lipoprotéines assurent le transport des lipides (cholestérol inclus) de l'intestin vers les autres tissus ;
- Les lipoprotéines à très basse densité (ou VLDL : Very Low Density lipoprotein).
Teneur en cholestérol dans l'alimentation
[réf. nécessaire] Aliment Teneur en cholestérol
(mg/100 g)Aliment Teneur en cholestérol
(mg/100 g)cervelle de veau 1 810 ris de veau 225 jaune d'œuf 1 560 crème 124 rognons de mouton ou de veau 400 poulet 90 à 100 rognons de porc 365 fromage 50 à 100 foie de porc 340 veau 84 foie de veau 314 merlan 77 foie de bœuf 265 bœuf 67 beurre 260 poisson 60 à 70 Ces teneurs en cholestérol alimentaire sont à compléter et relativiser par[6] :
- les teneurs en acides gras saturés (pouvant augmenter les taux en LDL) et insaturés trans (pouvant augmenter les taux en LDL et baisser les taux en HDL)
- les teneurs en acides gras mono-insaturés et poly-insaturés.
- L'apport alimentaire d'anti-oxydants (p.ex. vitamine E, vitamine C, β-carotène) pouvant limiter l'accumulation des LDL dans la paroi artérielle.
Le cholestérol présent dans les VLDL et LDL provient en effet des tissus (où il est excédentaire) qui l'ont synthétisé, et nullement des chylomicrons (structure de transport des lipides provenant de l'intestin). Limiter les apports alimentaires de cholestérol, ou son absorption au niveau de l'intestin (au travers de l'absorption intensive de phytostérols, par exemple), pour un individu ne souffrant pas d'hypercholestérolémie familiale, n'a par conséquent que peu d'effet prévention-santé.
Anomalies du dosage sanguin chez l'être humain
Le dosage du cholestérol sanguin se fait de manière traditionnelle chez un patient à jeun mais son taux global ainsi que sa fraction HDL ne sont pas modifiés de manière importante par le jeûne[7].
Hypercholestérolémie et athérosclérose
Dès le début du XIXe siècle, les travaux d’Anitschkow et Chalatow avaient permis de mettre en évidence un rôle du cholestérol dans l’athérosclérose expérimentale chez le lapin[8]. Aujourd'hui, plusieurs études ont montré que l’athérosclérose est une maladie inflammatoire[9],[10] et que l'agent agresseur est très probablement le cholestérol associé aux LDL après oxydation[11]. Parallèlement, plusieurs études ont mis en évidence un lien entre hypercholestérolémie et présence d’une réaction inflammatoire dans le tissu vasculaire[12],[13]. Aujourd'hui, l'important rôle du cholestérol et des LDL dans l'athérosclérose semble bien établi, en particulier depuis que les essais cliniques de prévention primaire et secondaire chez les sujets hypercholestérolémiques ont démontré qu’il était possible de réduire la fréquence des cardiopathies ischémiques en diminuant le cholestérol associé au LDL à l’aide de statines[14].
Le rôle du cholestérol dans l'athérosclérose a également été étudié d'un point du vue diététique. Au cours des années 1950-1960, L'américain Ancel Keys développe l'hypothèse lipidique faisant un lien entre le taux de cholestérol sanguin et le risque de maladie cardio-vasculaire[15][16]. L'activité physique régulière, l'alcool à faible dose et les œstrogènes pourraient contribuer à augmenter le taux de HDL, limitant le taux de cholestérol sanguin et améliorant la protection vasculaire[réf. nécessaire]. Inversement, le tabac, obésité et l'inactivité favorisent la diminution du taux de HDL dans le sang, augmentant le risque cardio-vasculaire[réf. nécessaire]. Rares sont ceux qui mettent cependant en question l'hypothèse lipidique d'Ancel Keys, communément admise, selon laquelle l'excès de consommation de graisses et le cholestérol seraient les principaux responsables des maladies cardio-vasculaires[17]. Ces avis sont à nuancer par le fait que la relation entre le taux de cholestérol sanguin et l'augmentation du risque cardiovasculaire semble établi solidement et de longue date par les études cliniques et épidémiologiques[15].
Défaut de synthèse
- La Chondrodystrophie calcifiante congénitale est une maladie génétique provoquant une altération du fonctionnement de la 3-β-hydroxystéroïde-δ(8), δ(7)-isomérase, une enzyme impliquée dans la synthèse du cholestérol.
- Le Syndrome de Smith-Lemli-Opitz est une maladie génétique provoquant un déficit en 7-déhydrocholestérol réductase, l'enzyme responsable de la dernière étape de la synthèse du cholestérol.
Prix Nobel concernant le cholestérol
L'étude de cette molécule a souvent été récompensée par des prix Nobel :
- en 1964, Konrad Bloch et Feodor Lynen reçurent le prix Nobel de médecine pour « leur découverte concernant le mécanisme de régulation des métabolismes du cholestérol et des acides gras »[18];
- en 1965, Robert Burns Woodward reçut le prix Nobel de chimie pour « ses exceptionnelles réalisations dans l'art de la synthèse organique »[19]. Il a été le premier à réaliser la synthèse chimique du cholestérol et de la cortisone en 1951;
- en 1985, Michael S. Brown et Joseph L. Goldstein reçurent le prix Nobel de médecine pour « leur découverte portant sur la régulation du métabolisme du cholestérol »[20].
Références
- ↑ a , b , c , d et e Entrée de « Cholesterol » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 24 juin 2009 (JavaScript nécessaire)
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ (en) Olson R.E., « Discovery of the Lipoproteins, Their Role in Fat Transport and Their Significance as Risk Factors »,The Journal of Nutrition, vol. 128:439S-443S, 1998
- ↑ Bactérie trouvée par des chercheurs de Jouy-en-Josas. découverte publiée par l'Applied and Environmental Microbiology, septembre 2007
- ↑ (fr) Banque de Données Automatisée sur les Médicaments : « Colestyramine », mise à jour du 13 octobre 2000
- ↑ (fr) www.objectif-equilibre-sante.info, « Diététique préventive cardio-vasculaire », au 14 novembre 2006
- ↑ Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report, Circulation, 2002;106:3143–3421
- ↑ (de) (en) Anitschkow N., Chalatow S., « On experimental cholesterin steatosis and its significance in the origin of some pathological processes », Centralblatt fur Allgemeine Pathologie und Pathologische Anatomie, vol. 24:1–9, 1913 (trad. dans Arteriosclerosis, vol. 3:178–182, 1983.
- ↑ (en) Davies M.J., « Stability and instability : Two faces of coronary atherosclerosis », Circulation, vol. 94:2013-2020, 1996.
- ↑ (en) Ross R., « Atherosclerosis-an inflammatory disease », N. Engl. J. Med., vol. 340:115-126, 1999.
- ↑ (en) Steinberg D., Parthasarathy S., Carew T.E., Khoo J.C., Witztum J.L., « Beyond cholesterol. Modifications of low-density lipoprotein that increase its atherogenicity », N. Engl. J. Med., vol. 320:915-924, 1989
- ↑ (en) Liao E., Andalibi A., Qiao J.H., Allayee H., Fogelman A.M., Lusis A.J., « Genetic evidence for a common pathway mediating oxidative stress, inflammatory gene induction, and aortic fatty streak formation in mice », J. Clin. Invest., vol. 94:877-884, 1994.
- ↑ (en) Young S.G., « Parthasarathy S.- Why are low-density lipoproteins atherogenic ? », West. J. Med., vol. 160:153-164, 1994.
- ↑ (en)Steinberg D., Gotto A.M. Jr., « Preventing coronary artery disease by lowering cholesterol levels : fifty years from bench to bedside », JAMA, vol. 282:2043-2050, 1999.
- ↑ a et b (en) Keys A., Taylor H.L., Blackburn H., Brozek J., Anderson J.T., Simonson E., « Coronary heart disease among Minnesota business and professional men followed 15 years », Circulation, vol. 28:381-95, 1963.
- ↑ (en) Keys A., « Seven countries: a multivariate analysis of death and coronary heart disease », Harvard University Press, London, 1980.
- ↑ (de) (fr) Gebbers J.L. (trad. Legoy M.), « Le cholestérol n'a rien à voir avec le développement de l'athérosclérose », Ars Medici, Vol. 9(98): S564-569
- ↑ (en) nobelprize.org, « The Nobel Prize in Physiology or Medicine 1964 »
- ↑ (en) nobelprize.org, « The Nobel Prize in Chemistry 1965 »
- ↑ (en) nobelprize.org, « The Nobel Prize in Physiology or Medicine 1985 »
Bibliographie
- (fr) Nouvelle Société Française d’Athérosclérose, « Athérosclérose:physiopathologie ».
- (en) Center for Disease Control and Prevention , « Ancel Keys, Ph.D. », Morbidity and Mortality Weekly Report, vol. 48(30):651, 1999.
- (fr) Poulletier de la salle et la découverte du cholestérol http://www3.chu-rouen.fr/NR/rdonlyres/CB9F36AD-8BC8-47ED-87F2-9A9BE1FE9E99/0/1994_feltgen2.pdf
Voir aussi
Articles connexes
- Portail de la médecine
- Portail de la biochimie
- Portail de la chimie
Catégories : Biologie du système cardio-vasculaire | Endocrinologie | Nutrition | Stéroïde | Alcool (chimie)
Wikimedia Foundation. 2010.