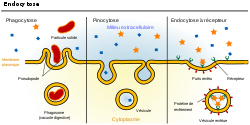
- Transport à la barrière hémato-encéphalique
-
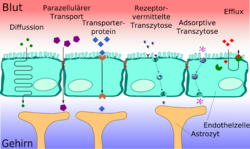
Il faut que la barrière hémato-encéphalique assure à la fois la protection, le transport d'aliments et d'oxygène vers le cerveau, et l’élimination des déchets. Les aliments solubles et les peptides franchissent la barrière hémato-encéphalique pour l’essentiel par des transporteurs ou des canaux spécifiques à travers la membrane cellulaire. La plupart des autres composés solubles passent – dans une certaine mesure – par diffusion passive[1],[2].
Sommaire
Transport paracellulaire
Dans les capillaires périphériques le transport de matières vers les organes et les muscles a lieu pour l'essentiel par des fenestrages et des fentes intercellulaires. Dans un endothélium cérébral sain et en bon état, les jonctions serrées relient les cellules entre elles de façon hermétique. Les capillaires du cerveau ne permettent donc qu'un transport de substances transmembranaire, qui peut d'ailleurs être mieux régulé que le transport paracellulaire[3]. L'eau, la glycérine et l'urée sont des exemples de molécules polaires assez petites pour pouvoir diffuser à travers les jonctions serrées[4].
Diffusion libre
La forme la plus simple de transport à travers la barrière hémato-encéphalique est représentée par la diffusion libre, souvent nommée diffusion passive. Cette diffusion peut en principe aussi bien survenir à travers la membrane cellulaire de l'endothélium qu'à travers les jonctions serrées. Comme pour toutes les diffusions, elle tend à égaliser la concentration, ou le potentiel électrochimique. Elle ne requiert aucune énergie de la part de la cellule. Le débit de matière est proportionnel à la différence de concentrations, et ne peut pas être régulé par la cellule[5].
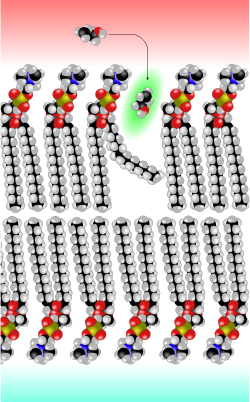 Modèle en calotte de membrane plasmique, avec un kink (angle) de la chaîne hydrophobe, qui laisse un espace libre (en vert) pour une petite molécule d'éthanol.
Modèle en calotte de membrane plasmique, avec un kink (angle) de la chaîne hydrophobe, qui laisse un espace libre (en vert) pour une petite molécule d'éthanol.
 Corrélation diffusion-lipophilie : représentation logarithmique de Pc (coefficient de perméabilité dans des capillaires de cerveau de rat, en cm/s), en fonction de Poctanol/eau (affinité relative octanol-eau, représentant la lipophilie). Au-dessus de la diagonale, substances qui soit sont transportées activement par la membrane (◊), soit diffusent passivement (eau). En-dessous, substances rejetées activement par les cellules endothéliales(Δ).
Corrélation diffusion-lipophilie : représentation logarithmique de Pc (coefficient de perméabilité dans des capillaires de cerveau de rat, en cm/s), en fonction de Poctanol/eau (affinité relative octanol-eau, représentant la lipophilie). Au-dessus de la diagonale, substances qui soit sont transportées activement par la membrane (◊), soit diffusent passivement (eau). En-dessous, substances rejetées activement par les cellules endothéliales(Δ).
Le biophysicien de Göttingen Hermann Träuble a mis au point en 1971 une théorie sur le transport des petites molécules à travers la membrane cellulaire. Selon cette théorie, ce sont des petits espaces entre les chaînes lipidiques de la double couche lipidique qui sont responsables du transport par diffusion. Ces trous proviennent de passages de la conformation trans à gauche (kinks trans-gauche-trans) dans les chaînes lipidiques des phospholipides de la membrane. Ces changements de conformation dièdres peuvent se produire avec une très faible énergie. En outre, ils sont mobiles et peuvent se déplacer avec la molécule occupant l'espace, à travers la membrane[6],[7],[8],[9]. La théorie de Träuble a été confirmée en 1974 par Anna et Joachim Seelig au moyen de la RMN[10],[11].
Les propriétés lipophiles de la membrane cellulaire et la liaison étanche par les jonctions serrées réduisent substantiellement le nombre de substances qui peuvent passer la barrière hémato-encéphalique. La perméabilité de la barrière pour une molécule donnée est en rapport direct avec ses propriétés lipophiles[12]. Par ailleurs, elle se comporte en proportion inverse de la masse molaire. Ceci signifie que plus une molécule est lipophile et petite, plus elle peut diffuser librement à travers l'endothélium[1]. Pour la masse molaire d'une molécule, on peut donner une limite supérieure de 400 à 500 g/mol, si la barrière est en bon état. Au-dessus de cette limite, les molécules ne peuvent pratiquement plus diffuser. Mais on ne peut pas considérer la barrière comme un tout ou rien, qui retiendrait complètement les grosses molécules, et laisserait librement passer les petites. Les processus de diffusion à la barrière sont des équilibres dynamiques. Pour une molécule de section 0,52 nm2 (correspondant à 200 g/mol), la barrière est 100 fois plus perméable que pour une molécule de section 1,05 nm2 (450 g/mol)[13],[14].
On peut caractériser utilement la lipophilie par le coefficient de partage octanol-eau, exprimant le logarithme des concentrations d'une molécule en présence d'un mélange octanol-eau. Par exemple, si logP est de 3,8, pour une substance, c'est qu'elle se dissout 103,8 fois plus dans l'octanol (lipophile) que dans l’eau (hydrophile). Les valeurs de logP positives caractérisent les substances lipophiles et les négatives les hydrophiles. Les substances lipophiles peuvent en principe passer plus facilement à travers les membranes plasmiques des cellules. Mais cet effet s'atténue au-dessus de 3, car les substances commencent à avoir une affinité pour se lier aux protéines. Néanmoins, logP est un indicateur important pour la capacité d'une substance à diffuser à travers la barrière hémato-encéphalique[15].
La prédiction du pouvoir de pénétration d'une substance dans le cerveau est possible au moyen de divers modèles et simulations : ex vivo ou encore in silico[16]. On peut faire des recherches in vitro fiables sur des cultures de cellules endothéliales isolées[2],[17],[14],[18].
La lipophilie et la petite taille ne sont aucune garantie de possibilité d'une diffusion vers le cerveau. Par exemple, plus de 98% des molécules de petite masse utilisées en pharmace ne sont pas en mesure de traverser la barrière hémato-encéphalique. Par contre les substances de masse moléculaire élevée en sont a priori exclues, comme les anticorps monoclonaux, les protéines recombinantes, les ARN anti-sens ou les aptamères[19].
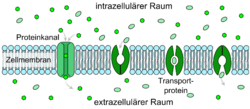
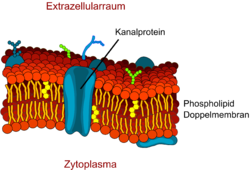
Perméabilité par canaux
Les petites molécules polaires, comme par exemple l'eau, ne peuvent diffuser par les kinks hydrophobes de la membrane que de façon très limitée. Cependant la barrière hémato-encéphalique présente une très grande perméabilité à l’eau. Ceci a été démontré par William Henry Oldendorf (1925-1992) par des expériences avec de l'eau tritiée[20].
Pour la diffusion de l’eau, on trouve dans la membrane cellulaire des protéines-canaux spécialisées, les aquaporines. Alors que les endothéliums périphériques expriment très souvent l'aquaporine-1 (AQP1), ce gène est inactivé à la barrière hémato-encéphalique, par la présence des astrocytes[21]. Les endothéliums cérébraux spécialisés expriment en réalité l'aquaporine-4 (AQP4)[22] et l'aquaporine-9 (AQP9). À la barrière hémato-encéphalique, l'aquaporine-9 est la plus importante pour le transport de l'eau[23]. Les aquaporines permettent la régulation de l'économie en eau du cerveau. Elles offrent une haute capacité de diffusion pour l’eau, dans les deux sens, toujours d'après le gradient osmotique[24].
Les aquaglycéroporines forment d'autres canaux dans la barrière hémato-encéphalique pour la glycérine, l'urée et l’ion méthanoate[23].
Les canaux sont substantiellement plus rapides pour le transport des molécules que les transporteurs. On peut activer ou désactiver les canaux à ions par des impulsions de tension électrique, des hormones qui agissent dessus, ou d'autres influences (diversité)[3].
Diffusion facilitée
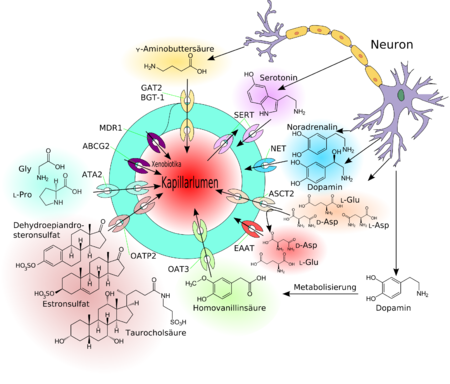
Une forme spéciale de diffusion à travers la membrane des cellules endothéliales est la « diffusion facilitée » (en anglais facilitated diffusion). Des aliments vitaux comme le glucose et beaucoup d'acides aminés sont trop polaires et trop gros pour emprunter en quantité suffisante les voies de transport à travers la barrière hémato-encéphalique énumérées ci-dessus. Pour ces molécules, il y a dans la membrane cellulaire un système spécial : la traversée par transporteur membranaire. Par exemple le glucose traverse par la molécule du transporteur GLUT-1. La densité du GLUT-1 sur la membrane luminale, dirigée vers le sang, est de 4 fois celle sur la membrane abluminale. La traversée de la cellule par le glucose se fait donc uniquement par gradient de concentration et ne nécessite en soi aucune énergie.
À côté de celui du glucose, nécessaire en relativement grandes quantités dans le cerveau, il y a toute une série de systèmes de transport spécialisés. Beaucoup de ces transporteurs sont dans la famille des solute carriers (SLC). Parmi eux, on peut citer les transporteurs de monocarboxylate MCT-1 et MCT-2, qui transportent tout un ensemble d'acides organiques à chaîne courte : acide lactique, pyruvique, mévalonique, butyrique ou acétique. Le SLC7 transporte des acides aminés cationiques (arginine, lysine, ornithine). Chez la souris, prise comme organisme-type, on connaît déjà 307 gènes SLC. Parmi ceux-ci, plus de 200 sont exprimés dans les plexus choroïdes et d'autres régions du cerveau. À la barrière hémato-encéphalique, on n'en a trouvé que 36 de cette nature. Et seulement 70% des 36 protéines ainsi fabriquées participent au transport d'aliments, de vitamines, d'hormones et d'éléments en traces. À la barrière hémato-encéphalique, sont particulièrement exprimés les transporteurs pour[25] :
- les hormones thyroïdiennes : SLC16a2 et SLCO1c1
- le sulfate : SLC13a4
- l'acide L-ascorbique (vitamine C) : SLC23a2
- les acides aminés : SLC 38a3
- le folate ou vitamine B9 : SLC19a1.
La vitamine C est transportée vers le cerveau par les transporteurs de glucose, sous sa forme oxydée[26].
Les protéines membranaires de transport peuvent fonctionner comme uniport (une molécule à la fois dans un seul sens), comme symport (deux molécules ou plus, dans le même sens) ou encore comme antiport (deux molécules ou plus en sens inverses)[27].
Transport actif
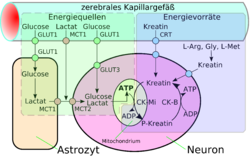 Schéma des voies et stockages d'énergie dans le système nerveux central[30]. En haut le capillaire, à gauche l’astrocyte, à droite le neurone avec une mitochondrie.
Schéma des voies et stockages d'énergie dans le système nerveux central[30]. En haut le capillaire, à gauche l’astrocyte, à droite le neurone avec une mitochondrie.
Avec les moyens de transport décrits ci-dessus, les molécules parviennent au cerveau sans consommation directe d'énergie. Elles suivent donc le gradient de la concentration, ou du produit des concentrations aux puissances convenables, dans les cas de transport multiple (symport ou antiport). Dans les transports actifs, ou « pompes », il est possible d'obtenir un transport à l’encontre du gradient de concentration. Pour cela, il faut néanmoins, directement ou indirectement, de l’énergie sous forme d'adénosine triphosphate (ATP)[3]. Quand le transport actif a lieu du sang vers le cerveau, on parle d'« influx » (à distinguer de l'« influx nerveux »), et en sens inverse, d'« efflux ».
Dans la barrière hémato-encéphalique, on trouve des transporteurs actifs en influx pour l'enképhaline[31],[32], la vasopressine (hormone antidiurétique) (AVP)[33] et la D-pénicillinamine2,5-enképhaline (DPDPE)[34] – le produit du gène de résistance multiple aux drogues (gène MDR1) a été le premier transporteur d'efflux identifié à la barrière hémato-encéphalique[35]. Là-dessus sont venues plus tard les protéines reliées aux résistances multidrogues, par exemple, le gène MRP1[36], qui appartiennent aussi à la famille des transporteurs ABC. La protéine de résistance au cancer mammaire (BCRP)[37],[38] se trouve avec la glycoprotéine P en réalité sur la paroi luminale, dirigée vers le sang, de l'endothélium[37],[39],[40].
Certains des transporteurs d'efflux – comme certains transporteurs d'influx – travaillent par stéréosélectivité. Ceci signifie qu'ils ne transportent qu'un seul énantiomère du cerveau vers la circulation sanguine. La D-asparagine est dans le cerveau un précurseur protéique de l'acide N-méthyl-D-aspartique (NMDA), et influe sur la sécrétion de diverses hormones, comme l'hormone lutéinisante, la testostérone ou l'ocytocine[41]. La L-asparagine appartient par contre, avec la L-glutamine aux acides aminés stimulants[42]. Le transporteur d'efflux ASCT2 (transporteur d'alanine, sérine et cystéine) de la barrière hémato-encéphalique ne transporte que la L-asparagine, dont l'accumulation aurait des effets neurotoxiques. La D-asparagine, nécessaire pour la production de NMDA, n'est pas transportée par l'ASCT2[43]. Les transporteurs EAAT (excitatory amino acid transporter – transporteurs d'acides aminés excitateurs) SLC1A3, SLC1A2 et SLC1A6 au contraire, transportent les deux énantiomères de l'asparagine[44],[30].
Dans le tissu épileptique la glycoprotéine P est sur-exprimée dans les endothéliums et les astrocytes de la barrière hémato-encéphalique, ainsi que dans les neurones[45],[46].
En outre, il y a des transporteurs d'anions organiques (OAT[47] et OATP[48]) et transporteurs de cations organiques[49] (OCT)[50] dans la membrane cellulaire de l’épithélium. Les transporteurs d'efflux, spécialement, peuvent transporter activement une grande quantité de substrats non spécifiques[5].
Pour tout un ensemble de processus de transport au niveau de l'endothélium, il n'est pas encore clarifié s'il s'agit de processus actifs (c'est-à-dire consommant de l’ATP), ou s'il s'agit seulement de diffusion facilitée par transporteur membranaire[30].
Transport vésiculaire
Les grosses molécules, ou même agrégats, qui ne peuvent pas utiliser de protéine membranaire de transport sont incorporées dans la cellule par un mécanisme d'endocytose : la membrane plasmique se déforme en puits autour de l'objet à ingérer, se referme et se détache du milieu ambiant. On distingue trois grandes catégories d'endocytose : phagocytose pour digérer, pinocytose pour incorporer une partie du milieu ambiant, et endocytose à récepteur, qui sélectionne la molécule à ingérer par des récepteurs spécifiques. Cette dernière, avec une variante électrostatique, est susceptible d'être combinée avec son inverse à la face abluminale, pour donner une transcytose.
Transcytose à récepteurs
Pour la capture de grosses molécules sélectionnées, il y a au puits de la membrane, des récepteurs qui se lient spécifiquement à la molécule visée[51]. C'est par exemple le cas pour la transferrine, grosse molécule, transporteuse de fer, de masse molaire de 76 kDa, et composée de 679 acides aminés[52]. Les récepteurs se trouvent dans la lumière du capillaire à la surface d'une dépression marquée sur la face interne de la membrane par des protéines de marquage. Après liaison à la transferrine, la membrane se replie sur elle même en creusant le puits, puis en soudant le bord, donnant ainsi une vésicule marquée vers le plasma cellulaire. Cette vésicule marquée est alors transportée vers le côté abluminal, et expulse la transferrine par un processus symétrique. C'est le même mécanisme qui permet le transport via les récepteurs à LDL de la Lipoprotéine de basse densité (LDL) vers le cerveau, pour que le cholestérol y soit fabriqué[53],[17]. L'insuline[54] et d'autres hormones peptidiques, comme les cytokines arrivent de cette manière au cerveau[51].
Transcytose par adsorption
Dans la transcytose par adsorption (adsorptive-mediated transcytosis, AMT), les interactions électrostatiques entre la surface cellulaire négativement chargée par des glycoprotéines et des molécules chargées positivement (cations) aboutissent à un transport à travers le cytoplasme des cellules épithéliales[55]. Cette forme de transport est également nommée « transport cationique »[56]. Les molécules chargées positivement sont par exemple les peptides et les protéines dont le point isoélectrique se situe nettement au-dessus du pH ambiant[57]. La transcytose cationique à travers l'endothélium de la barrière hémato-encéphalique permet un plus haut débit de tansport que la transcytose à récepteurs[58].
Principaux transporteurs à la barrière hémato-encéphalique
Transporteur Nom anglais Gène Loc. gène Fam. Réf. Diffusion facilitée GLUT1 glucose transporter 1 SLC2A1 1 p35-p31.3 SLC [59] LAT1 large neutral amino acid transporter 1 SLC7A5 16 q24.3 SLC [59] CAT1 cationic amino acid transporter 1 SLC7A1 13 q12.3 SLC [59] MCT1 monocarboxylic acid transporter 1 SLC16A1 1 p13.2-p12 SLC [59] CNT2 concentrative nucleoside transporter 2 SLC28A2 15 q15 SLC [59] CHT1 choline transporter 1 SLC5A7 2 q12 SLC [59] NBTX nucleobase transporter ? ? [59] Efflux actif MDR1 P-Glycoprotein ABCB1 7 q21.1 ABC [60] MRP1 multidrug resistance protein 1 ABCC1 16 p13.1 ABC [60] MRP3 multidrug resistance protein 3 ABCC3 17 q22 ABC [60] MRP4 multidrug resistance protein 4 ABCC4 13 q32 ABC [60] MRP5 multidrug resistance protein 5 ABCC5 3 q27 ABC [60] BCRP breast cancer resistance protein ABCG2 4 q22 ABC [60] OAT3 organic anion transporter 3 SLC22A8 11 SLC [30] OATP-A organic anion transporter polypeptide A SLC21A3 12 p12 SLC [30] OATP3A1 organic anion transporter polypeptide 3 SLCO1A2 15 q26 SLC [30] EAAT1 excitatory amino acid transporter 5 SLC1A3 5 p13 SLC [30] TAUT taurin transporter SLC6A6 3 p25-q24 SLC [59] Transport à récepteurs INSR Insulin receptor INSR 19 p13.2 [59] TFR1 transferrin receptor TFRC 3 q29 [59] IGF1R insulin-like growth factor 1 receptor IGF1R 15 q25-q26 [59] LEPR leptin receptor LEPR 1 p31 [59] FCGRT Fc fragment of IgC, receptor transporter FCGRT 19 q13.3 [59] SCARB1 scavenger receptor class B 1 SCARB1 12 q24.31 [59] Le jeu de la nombreuse famille SLC et des transporteurs ABC est un mécanisme remarquablement efficace de protection de la barrière hémato-encéphalique contre l’entrée des xénobiotiques dans le cerveau[61],[62].
Bibliographie
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Blut-Hirn-Schranke » (voir la liste des auteurs)
- Extraits du cours de PCEM1 du Pr Bertrand Bloch (PU-PH) sur le tissu nerveux, Université Victor Segalen, Bordeaux 2.
- (en) D. Kobiler, Blood-brain Barrier., Springer Verlag, 2001 (ISBN 0-306-46708-9)
- (en) W. M. Pardridge, Introduction to the Blood-brain Barrier., Cambridge University Press, 1998 (ISBN 0-521-58124-9)
- (en) A. G. De Boer et W. Sutanto, Drug Transport Across the Blood-brain Barrier., CRC Press, 1997 (ISBN 90-5702-032-7)
- (en) E. M. Taylor, Efflux Transporters and the Blood-brain Barrier., Nova Publishers, 2005 (ISBN 1-59454-625-8)
- (en) D. J. Begley, The Blood-brain Barrier and Drug Delivery to the CNS., Informa Health Care, 2000 (ISBN 0-8247-0394-4)
- (de) P. Ramge, Untersuchungen zur Überwindung der Blut-Hirn-Schranke mit Hilfe von Nanopartikeln., Shaker Verlag, 1999 (ISBN 3-8265-4974-0)
Références
- (de) Stephanie Nobmann, « Isolierte Gehirn-Kapillaren als in vitro-Modell der Blut-Hirn Schranke », Ruprecht-Karls-Universität Heidelberg, juin 2001. Consulté le 29 avril 2010
- (en) Y. Takakura, K.L. Audus et R.T. Borchardt, « Blood-brain barrier: transport studies in isolated brain capillaries and in cultured brain endothelial cells. », dans Adv. Pharmacol., vol. 22, 1991, p. 137–165 [lien PMID (page consultée le 29 avril 2010)] (article de revue)
- (de) M. Fromm, Physiologie des Menschen – Transport in Membranen und Epithelien., Springer Verlag (R. F. Schmidt, F. Lang) (ISBN 978-3-540-32908-4), p. 41–54
- (de) Ines Sauer, « Apolipoprotein E abgeleitete Peptide als Vektoren zur Überwindung der Blut-Hirn-Schranke. », dans Thèse de doctorat, Freie Universität Berlin, 2004 [texte intégral (page consultée le 4 mai 2010)]
- (en) Richard D. Egleton et Thomas P. Davis, « Development of neuropeptide drugs that cross the blood-brain barrier. », dans NeuroRx, The American Society for Experimental NeuroTherapeutics, vol. 2, 2005, p. 44–53 [texte intégral, lien PMID (pages consultées le 5 mai 2010)] (article de revue).
- (en) H. Träuble, « Carriers and specificity in membranes. 3. Carrier-facilitated transport. Kinks as carriers in membranes. », dans Neurosci. Res. Program Bull., vol. 9, 1971, p. 361–372 [lien PMID (page consultée le 5 mai 2010)]
- (de) H. Träuble, « Phasenumwandlungen in Lipiden. Mögliche Schaltprozesse in biologischen Membranen. », dans Naturwissenschaften, Springer Verlag, vol. 58, 1971, p. 277–284 [lien PMID (page consultée le 5 mai 2010)]
- (de) O. Vostowsky, « Chemie der Naturstoffe - Lipoproteine und Membranen. », dans Vorlesung, Universität Erlangen, 2005, p. 42 [texte intégral (page consultée le 5 mai 2010)]
- (de) W. Hoppe et R. D. Bauer, Biophysik., Bâle, Birkhäuser Verlag, 1982 (ISBN 0-387-11335-5), p. 447–448
- (en) Anna Seelig et Joachim Seelig, « The dynamic structure of fatty acyl chains in a phospholipid bilayer measured by deuterium magnetic resonance. », dans Biochemistry, vol. 13, 1974, p. 4839–4845 [lien PMID (page consultée le 5 mai 2010)]
- (en) « Die Permeation kleiner polarer Moleküle durch Phospholipidmodellmembranen », dans Thèse de doctorat, Universität Kaiserslautern, 1999 [texte intégral (page consultée le 5 mai 2010)]
- (en) W. H. Oldendorf, « Lipid solubility and drug penetration of the blood-brain barrier. », dans Proc. Soc. Exp. Biol. Med., vol. 147, 1974, p. 813–816 [lien PMID (page consultée le 5 mai 2010)]
- (en) H. Fischer, R. Gottschlich et A. Seelig, « Blood–brain barrier permeation: molecular parameters governing passive diffusion. », dans J. Membr. Biol., vol. 165, 1998, p. 201–211 [lien PMID (page consultée le 29 avril 2010)]
- (en) Roman Kaliszan et Micha Markuszewski, « Brain/blood distribution described by a combination of partition coefficient and molecular mass. », dans International Journal of Pharmaceutics, Elsevier, vol. 145, 1996, p. 9–16 [lien DOI (page consultée le 11 mai 2010)]
- (en) V. A. Levin, « Relationship of octanol/water partition coefficient and molecular weight to rat brain capillary permeability. », dans J. Med. Chem., vol. 23, 1980, p. 682–684 [lien PMID (page consultée le 5 mai 2010)]
- (en) Anna Seelig, Rudolf Gottschlich et Ralf M. Devant, « A method to determine the ability of drugs to diffuse throught the blood-brain barrier. », dans PNAS, National Academy of Sciences (États-Unis), vol. 91, 1994, p. 68–72 [texte intégral, lien PMID (pages consultées le 5 mai 2010)]
- (en) G. A. Dhopeshwarkar et J. F. Mead, « Uptake and transport of fatty acids into the brain and the role of the blood-brain barrier system. », dans Adv. Lipid Res., vol. 11, 1973, p. 109–142 [lien PMID (page consultée le 5 mai 2010)] (article de revue).
- (en) Grégori Gerebtzoff et Anna Seelig, « In silico prediction of blood-brain barrier permeation using the calculated molecular cross-sectional area as main parameter. », dans J. Chem. Inf. Model., vol. 46, 2006, p. 2638–2650 [lien PMID (page consultée le 5 mai 2010)]
- (en) William M. Pardridge, « The blood-brain barrier: bottleneck in brain drug development. », dans NeuroRx, vol. 2, 2005, p. 3–14 [texte intégral (page consultée le 5 mai 2010)] (article de revue).
- (en) William H. Oldendorf, « Measurement of brain uptake of radiolabeled substances using a tritiated water internal standard. », dans Brain Res., Elsevier, vol. 24, 1970, p. 372–376 [lien PMID (page consultée le 6 mai 2010)]
- (en) D. Dolman, S. Drndarski, N.J. Abbott et M. Rattray, « Induction of aquaporin 1 but not aquaporin 4 messenger RNA in rat primary brain microvessel endothelial cells in culture. », dans J. Neurochem., vol. 93, 2005, p. 825–833 [lien PMID (page consultée le 6 mai 2010)]
- (en) O. Bloch et G. T. Manley, « The role of aquaporin-4 in cerebral water transport and edema. », dans Neurosurg. Focus, vol. 22, 2007, p. E3 [lien PMID (page consultée le 6 mai 2010)] (article de revue)
- (en) J. Badaut, J.F. Brunet et L. Regli, « Aquaporins in the brain: from aqueduct to "multi-duct". », dans Metab. Brain Dis., Springer Verlag, vol. 22, 2007, p. 251–263 [lien PMID (page consultée le 6 mai 2010)] (article de revue)
- (en) A. S. Verkman, « More than just water channels: unexpected cellular roles of aquaporins. », dans J. Cell Sci., vol. 118, 2005, p. 3225–3232 [lien PMID (page consultée le 6 mai 2010)] (article de revue).
- (en) Amber Dahlin, Josh Royall, John G. Hohmann et Joanne Wang, « Expression Profiling of the Solute Carrier (SLC) Gene Family in the Mouse Brain. », dans J. Pharmacol. Exp. Ther., vol. 329, 2009, p. 558-70 [texte intégral, lien PMID (pages consultées le 7 mai 2010)]
- (en) D. B. Agus, S. S. Gambhir, W. M. Pardridge, C. Spielholz, J. Baselga, J. C. Vera et D. W. Golde, « Vitamin C crosses the blood-brain barrier in the oxidized form through the glucose transporters. », dans J. Clin. Invest., vol. 100, 1997, p. 2842–2848 [lien PMID (page consultée le 7 mai 2010)]
- (en) E. M. Cornford et S. Hyman, « Blood-brain barrier permeability to small and large molecules. », dans Adv. Drug Deliv. Rev., vol. 36, 1999, p. 145–163 [lien PMID (page consultée le 7 mai 2010)]
- (en) Vallabhaneni V. Rao, Julie L. Dahlheimer, Mark E. Bardgett, Abraham Z. Snyder, Rick A. Finch, Alan C. Sartorelli et David Piwnica-Worms, « Choroid plexus epithelial expression of MDR1 P glycoprotein and multidrug resistance-associated protein contribute to the blood-cerebrospinal-fluid drug-permeability barrier. », dans PNAS, vol. 96, 1999, p. 3900–3905 [texte intégral, lien PMID (pages consultées le 7 mai 2010)]
- (en) Franz Thiebaut, Takahashi Tsuruo, Hirofumi Hamada, Michael M. Gottesman, Ira Pastan et Mark C. Willingham, « Immunohistochemical localization in normal tissues of different epitopes in the multidrug transport protein P170: evidence for localization in brain capillaries and crossreactivity of one antibody with a muscle protein. », dans J. Histochem. Cytochem., vol. 37, 1989, p. 159–164 [texte intégral, lien PMID (pages consultées le 7 mai 2010)]
- (en) Sumio Ohtsuki, « New Aspects of the Blood–Brain Barrier Transporters; Its Physiological Roles in the Central Nervous System », dans Biol. Pharm. Bull., vol. 27, 2004, p. 1489–1496 [texte intégral, lien PMID (pages consultées le 28 avril 2010)] (article de revue)
- (en) B. V. Zloković, M. N. Lipovac, D. J. Begley, H. Davson et L. Rakić, « Transport of leucine-enkephalin across the blood-brain barrier in the perfused guinea pig brain. », dans J. Neurochem., vol. 49, 1987, p. 310–315 [lien PMID (page consultée le 7 mai 2010)]
- (en) B. V. Zlokovic, J. B. Mackic, B. Djuricic et H. Davson, « Kinetic analysis of leucine-enkephalin cellular uptake at the luminal side of the blood-brain barrier of an in situ perfused guinea-pig brain. », dans J. Neurochem., vol. 53, 1989, p. 1333–1340 [lien PMID (page consultée le 7 mai 2010)]
- (en) B. V. Zlokovic, S. Hyman, J. G. McComb, M. N. Lipovac, G. Tang et H. Davson, « Kinetics of arginine-vasopressin uptake at the bloodbrain barrier. », dans Biochim. Biophys. Acta, vol. 1025, 1990, p. 191–198 [lien PMID (page consultée le 7 mai 2010)]
- (en) S. A. Thomas, T. J. Abbruscato, V. J. Hruby et T. P. Davis, « The entry of [D-penicillamine2,5]enkephalin into the central nervous system: saturation kinetics and specificity. », dans J. Pharmacol. Exp. Ther., vol. 280, 1997, p. 1235–1240 [lien PMID (page consultée le 7 mai 2010)]
- (en) David J. Begley, « ABC transporters and the blood-brain barrier. », dans Curr. Pharm. Des., vol. 10, 2004, p. 1295–1312 [lien PMID (page consultée le 7 mai 2010)] (article de revue).
- (en) Seeta Seetharaman, Margery A. Barrand, Lynn Maskell et Rik J. Scheper, « Multidrug resistance-related transport proteins in isolated human brain microvessels and in cells cultured from these isolates. », dans J. Neurochem., vol. 70, 1998, p. 1151–1159 [lien PMID (page consultée le 7 mai 2010)]
- (en) H. C. Cooray, C. G. Blackmore, L. Maskell et M. A. Barrand, « Localisation of breast cancer resistance protein in microvessel endothelium of human brain. », dans Neuroreport, vol. 13, 2002, p. 2059–2063 [lien PMID (page consultée le 7 mai 2010)]
- (en) Tanja Eisenblätter et Hans-Joachim Galla, « A new multidrug resistance protein at the blood-brain barrier. », dans Biochem. Biophys. Res. Commun., Elsevier, vol. 293, 2002, p. 1273–1278 [lien PMID (page consultée le 7 mai 2010)]
- (en) Y Tanaka, « Ultrastructural localization of P-glycoprotein on capillary endothelial cells in human gliomas. », dans Virchows Arch., vol. 425, 1994, p. 133–138 [lien PMID (page consultée le 7 mai 2010)]
- (en) E. C. de Lange, « Potential role of ABC transporters as a detoxification system at the blood-CSF barrier. », dans Adv. Drug Deliv. Rev., vol. 56, 2004, p. 1793–1809 [lien PMID (page consultée le 7 mai 2010)] (article de revue).
- (en) H. Wolosker, R. Panizzutti et J. De Miranda, « Neurobiology through the looking-glass: D-serine as a new glial-derived transmitter. », dans Neurochem. Int., vol. 41, 2002, p. 327—332 [lien PMID (page consultée le 8 mai 2010)] (article de revue).
- (en) C. F. Zorumski et J. W. Olney, « Excitotoxic neuronal damage and neuropsychiatric disorders », dans Pharmacol. Ther., vol. 59, 1993, p. 145–162 [lien PMID (page consultée le 8 mai 2010)] (article de revue).
- (en) Ken-ichi Hosoya, Michiko Sugawara, Hiroshi Asaba et Tetsuya Terasaki, « Blood-brain barrier produces significant efflux of L-aspartic acid but not D-aspartic acid: in vivo evidence using the brain efflux index method. », dans J. Neurochem., Wiley, vol. 73, 1999, p. 1206—1211 [lien PMID (page consultée le 8 mai 2010)]
- (en) Manuel Palacín, Raúl Estévez, Joan Bertran et Antonio Zorzano, « Molecular biology of mammalian plasma membrane amino acid transporters. », dans Physiol. Rev., vol. 78, 1998, p. 969—1054 [texte intégral, lien PMID (pages consultées le 8 mai 2010)]
- (en) Wolfgang Löscher et Heidrun Potschka, « Blood-brain barrier active efflux transporters: ATP-binding cassette gene family. », dans NeuroRx, vol. 2, 2005, p. 86–98 [texte intégral, lien PMID (pages consultées le 8 mai 2010)] (article de revue).
- (en) D. M. Tishler, K. I. Weinberg, D. R. Hinton, N. Barbaro, G. M. Annett et C. Raffel, « MDR1 gene expression in brain of patients with medically intractable epilepsy. », dans Epilepsia, vol. 36, 1995, p. 1–6 [lien PMID (page consultée le 8 mai 2010)]
- (en) Hiroyuki Kusuhara, Takashi Sekine, Naoko Utsunomiya-Tate, Minoru Tsuda, Ryoji Kojima, Seok Ho Cha, Yuichi Sugiyama, Yoshikatsu Kanai et Hitoshi Endou, « Molecular cloning and characterization of a new multispecific organic anion transporter from rat brain. », dans J. Biol. Chem., vol. 274, 1999, p. 13675–13680 [texte intégral, lien PMID (pages consultées le 8 mai 2010)]
- (en) Bo Gaoa, Bruno Stiegera, Birgitta Noéa, Jean-Marc Fritschya et Peter J. Meier, « Localization of the organic anion transporting polypeptide 2 (Oatp2) in capillary endothelium and choroid plexus epithelium of rat brain. », dans J. Histochem. Cytochem., vol. 47, 1999, p. 1255–1264 [texte intégral, lien PMID (pages consultées le 8 mai 2010)]
- (en) L. Z. Bito, « Blood-Brain Barrier: Evidence for Active Cation Transport between Blood and the Extraceliular Fluid of Brain. », dans Science, American Association for the Advancement of Science (États-Unis), vol. 165, 1969, p. 81–83 [lien PMID (page consultée le 8 mai 2010)]
- (en) Yasuto Kido, Ikumi Tamai, Aki Ohnari, Yoshimichi Sai, Toru Kagami, Jun-ichi Nezu, Hiroko Nikaido, Noriyoshi Hashimoto, Masahide Asano et Akira Tsuji, « Functional relevance of carnitine transporter OCTN2 to brain distribution of L-carnitine and acetyl-L-carnitine across the blood-brain barrier. », dans J. Neurochem., Wiley, vol. 79, 2001, p. 959–969 [lien PMID (page consultée le 8 mai 2010)]
- (de) Sabine Wolf, Bernhard Seehaus, Klaus Minol et Hans Günter Gassen, « Die Blut-Hirn-Schranke : Eine Besonderheit des cerebralen Mikrozirkulationssystems. », dans Naturwissenschaften, Springer, vol. 83, 83, p. 302–311 [résumé, lien DOI (pages consultées le 20 février 2010)]
- (en) R. L. Roberts, R. E. Fine et A. Sandra, « Receptor-mediated endocytosis of transferrin at the blood-brain barrier. », dans J. Cell Sci., vol. 104, 1993, p. 521–532 [résumé, lien PMID (pages consultées le 8 mai 2010)]
- (en) Bénédicte Dehouck, Marie-Pierre Dehouck, Jean-Charles Fruchart et Romeo Cecchelli, « Upregulation of the low density lipoprotein receptor at the blood-brain barrier: intercommunications between brain capillary endothelial cells and astrocytes. », dans J. Cell Biol., vol. 126, 1994, p. 465–473 [texte intégral, lien PMID (pages consultées le 8 mai 2010)]
- (en) K. R. Duffy, W. M. Pardridge et R. G. Rosenfeld, « Human blood-brain barrier insulin-like growth factor receptor. », dans Metabolism, vol. 37, 1988, p. 136–140 [lien PMID (page consultée le 8 mai 2010)]
- (en) Mathew W. Smith et Mark Gumbleton, « Endocytosis at the blood-brain barrier: from basic understanding to drug delivery strategies. », dans J. Drug Target, vol. 14, 2006, p. 191–214 [lien PMID (page consultée le 9 mai 2010)] (article de revue).
- (en) Françoise Hervé, Nicolae Ghinea et Jean-Michel Scherrmann, « CNS delivery via adsorptive transcytosis. », dans AAPS J., vol. 10, 2008, p. 455–472 [texte intégral, lien PMID (pages consultées le 9 mai 2010)]
- (en) J. -M. Scherrmann, « Drug delivery to brain via the blood-brain barrier. », dans Vascul. Pharmacol., vol. 38, 2002, p. 349–354 [lien PMID (page consultée le 9 mai 2010)] (article de revue).
- (en) Ikumi Tamai, Yoshimichi Sai, Hiroyuki Kobayashi, Makoto Kamata, Tateaki Wakamiya et Akira Tsuji, « Structure-internalization relationship for adsorptive-mediated endocytosis of basic peptides at the blood– brain barrier. », dans J. Pharmacol. Exp. Ther., vol. 280, 1997, p. 410–415 [texte intégral, lien PMID (pages consultées le 9 mai 2010)]
- (en) W. M. Pardridge, « Blood-brain barrier delivery. », dans Drug Discov. Today, vol. 12, 2007, p. 54–61 [lien PMID (page consultée le 9 mai 2010)]
- (en) Holger Bronger, Jörg König, Kathrin Kopplow, Hans-Herbert Steiner, Rezvan Ahmadi, Christel Herold-Mende, Dietrich Keppler et Anne T. Nies, « ABCC drug efflux pumps and organic anion uptake transporters in human gliomas and the blood-tumor barrier. », dans Cancer Res., vol. 65, 2005, p. 11419–11428 [texte intégral, lien PMID (pages consultées le 9 mai 2010)]
- (en) Hiroyuki Kusuhara et Yuichi Sugiyama, « Active efflux across the blood-brain barrier: role of the solute carrier family. », dans NeuroRx, vol. 2, 2005, p. 73-85 [texte intégral, lien PMID (pages consultées le 10 mai 2010)] (article de revue).
- (en) Jean-Michel Scherrmann, « Expression and function of multidrug resistance transporters at the blood-brain barriers. », dans Expert Opin. Drug Metab. Toxicol., vol. 1, 2005, p. 233–246 [lien PMID (page consultée le 10 mai 2010)] (article de revue).
Voir aussi
Catégories :- Annexes du système nerveux
- Pharmacologie
- Système nerveux central
- Neuroanatomie
- Cerveau
- Anatomie du système cardio-vasculaire
Wikimedia Foundation. 2010.