- Protéine recombinante
-
Une protéine recombinante (ou protéine hétérologue[1]) est une protéine produite par une cellule dont le matériel génétique a été modifié par recombinaison génétique. Un gène codant une protéine d’intérêt est introduit dans le génome de l’espèce productrice (bactéries, cellules mammifères en culture, animaux transgéniques, etc.). Les protéines recombinantes peuvent être purifiées et utilisées à des fins thérapeutiques, industrielles ou bien encore dans les activités de recherche.
Sommaire
Historique
[11]
C’est en 1972 que les premières manipulations in vitro sur gènes ont commencé. A cette époque, le biochimiste Paul Berg obtient le premier ADN recombinant grâce aux enzymes de restriction. Un an plus tard, S.Cohen et H. Boyer parviennent à introduire des gènes d’amphibien dans la bactérie Escherichia coli. Le premier organisme transgénique est né. Dans les années 80, le premier produit issu du génie génétique est commercialisé. Il s’agit de l’insuline recombinante humaine produite par des bactéries génétiquement modifiées. C’est aussi à cette période que les scientifiques se rendent compte que toutes les protéines produites par cette méthode ne sont pas fonctionnelles. Ce problème vient du fait que les bactéries n’ont pas toute la machinerie qui permet aux protéines d’avoir leur maturation post-traductionnelle et donc d’acquérir une activité biologique. Les chercheurs se tournent alors vers des modèles de cellules eucaryotes. En 1982, la première souris transgénique voit le jour. Elle produit une quantité d’hormone plus grande que la normale.
Construction du transgène
[3];[12];[14];[16]
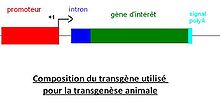
Composition du transgène
- Le vecteur est un moyen de transport de l’ADN. C’est un fragment capable de réplication autonome et qui peut supporter l’insertion d’un autre fragment d’ADN de taille variable (plasmide bactérien).
- L’organisme donneur exprime la protéine d’intérêt. L’ARNm codant cette protéine est isolé de cet organisme. L’ARNm permet la synthèse de l’ADNc qui sera utilisé pour le clonage. En effet, l’ADN génomique eucaryote n’est pas utilisable dans un système bactérien car les bactéries ne possèdent pas la machinerie d’épissage des ARNm eucaryotes.
C’est pourquoi la technique RT-PCR est souvent utilisée pour l’obtention de l’ADNc codant le gène d’intérêt. Suite à la réverse transcription des ARNm totaux en ARNm, l’ADNc correspondant à l’ARNm codant la protéine d’intérêt est amplifié par PCR en utilisant des amorces spécifiques auxquels sont ajoutés des sites de restrictions qui seront ensuite utilisés pour le clonage.
- Séquences régulatrices
Une fois l’ADNc d’intérêt amplifié, il lui faut ajouter les séquences permettant de cibler le tissu de transcription ainsi que les signaux de terminaison de la transcription et de la traduction. Ces séquences sont souvent présentes sur le plasmide dans lequel est cloné le gène d’intérêt :
- - En 5’ : un promoteur spécifique du tissu dans lequel l’expression est attendue, ainsi qu’un intron dans le cas ou la transgenèse est réalisée en modèle eucaryote.
- En 3’ : un codon stop ainsi qu’un signal de polyadénylation.
Avec les bactéries il n’y a pas besoin d’introns.
Clonage du gène d'intérêt
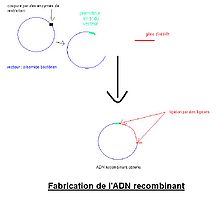
ADN recombinant :
L’ADNc amplifié par PCR est cloné dans un vecteur (chromosome artificiel bactérien, chromosome artificiel de levure, plasmide bactérien, etc.) contenant les séquences régulatrices décrites précédemment.
Pour cela, le vecteur (ici plasmide) ainsi que l’ADNc du gène d’intérêt sont digérés par des enzymes de restriction différentes afin d’orienter l’insertion de l’ADNc avant de liguer l’ADNc dans le plasmide à l’aide d’une ligase.
Le plasmide recombinant est ensuite introduit dans une bactérie, par transformation, afin d’amplifier le vecteur qui sera ensuite purifié. Avant de réaliser la transgenèse, le vecteur est linéarisé et les signaux de réplication bactériens ainsi que les gènes de résistances présents sur le plasmide sont éliminés par utilisation d’enzymes de restriction.
Transgenèse et animaux fondateurs
[2];[5];[10];[14];[17]
Transgenèse
C’est une technique consistant à l’intégration d’un gène exogène au génome d’un organisme hôte. Le but de cette manipulation est de permettre à l’hôte de produire une protéine d’intérêt non produite par une espèce donnée ou bien de le produire en plus grande quantité (utilisé dans les activités de recherche)[2].
Choix de l'hôte
Il se fera en fonction de l’utilisation désirée de la protéine recombinante ainsi que des mécanismes cellulaires nécessaires à la production d’une protéine fonctionnelle :
- Bactéries : forte croissance, niveau de sécrétion variable mais pas de modification post-traductionnelle. Formation de corps d’inclusion si la protéine n’est pas sécrétée.
- Levures : faciles à cultiver, modifications post-traductionnelles, bonne expression mais faible capacité de sécrétion des grosses protéines.
- Champignons : bonne sécrétion, modifications post-traductionnelles mais parfois indésirables.
- Cellules de mammifères : production de grosses molécules possible mais faible rendement pour des couts élevés.
- Plantes : Utilisées dans le cas de productions de plantes transgéniques OGM permettant une résistance à des parasites ou à des pesticides. Ex : Maïs Bt
- Animaux : productions de grosses molécules, possibilité de consommer les protéines recombinantes dans l’alimentation, nécessite de grande structure pour l’élevage.
Introduction du gène d’intérêt dans le génome hôte
- Pour les bactéries et les levures, le transgène sera soit introduit dans la cellule sur un plasmide, soit intégré au génome bactérien par double recombinaison homologue.
- Chez les végétaux, l’intégration de l’ADN recombinant se fait grâce à un « canon à ADN », qui projette des microbilles d'or ou de tungstène enrobées d'ADN ou par l’utilisation de bactéries capables de transférer de l’ADN à sa cellule hôte (ex : Agrobactérium tumefasciens)
- Pour les animaux, l’injection d’une solution contenant l’ADN recombinant sous forme linéaire est injecté dans le pronucléus mâle d’une cellule œuf avant l’étape de caryogamie. L’ADN injecté sera intégré au génome par les mécanismes de réparation de l’ADN de la cellule hôte. La drosophile, le poisson zèbre, le vers nématode, le poulet, le Xénope, la souris sont des animaux très utilisés.
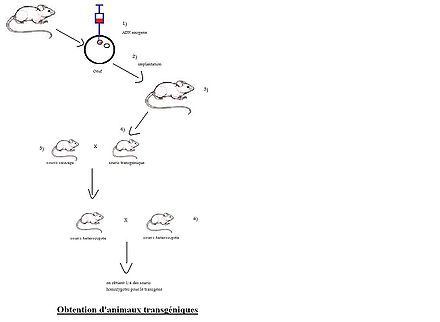
Exemple de transgenèse en modèle murin :
L’ADN exogène est injecté dans le pronucleus mâle
- Les œufs viables sont réimplantés dans une mère porteuse préparée à recevoir un embryon
- Chez la souris porteuse, l’ADN injecté est intégré à l’ADN hôte par les mécanismes de réparation de l’ADN. Les souris transgéniques sont identifiées par PCR.
- Croisement entre des souris sauvages et les souris transgéniques permet d’obtenir des souris hétérozygotes pour le transgène.
- Si nécessaire, un croisement entre deux souris hétérozygotes permet d’obtenir des souris homozygotes pour le transgène.
Suite à sa production la protéine est purifiée grâce à des méthodes biochimiques comme la chromatographie sur colonne, HPLC, …
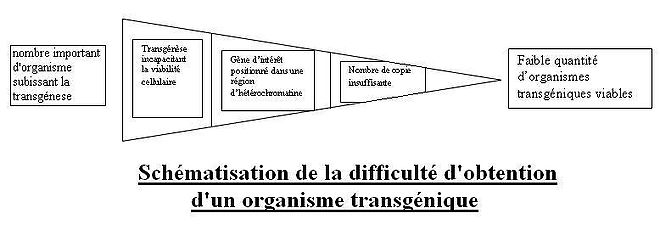
Problèmes fréquents
Il est possible que le nombre de copie du transgène intégré soit insuffisant pour permettre une production de protéine d’intérêt en concentration satisfaisante pour son utilisation à grande échelle. Au contraire, l’expression du gène transféré peut être muette. En effet, si ce dernier s’est intégré au niveau d’une région d’hétérochromatine, le gène ne se verra pas transcrit et donc pas exprimé. L’intégration du transgène peut également avoir des conséquences néfastes sur le développement de l’organisme hôte:
- Par un changement de besoin nutritionnel
- L’expression du transgène dans une zone non ciblée créant des traumatismes des tissus (expression ectopique)
- Une surproduction du transgène menant à un phénotype délétère
- Le blocage de l’expression d’un gène endogène si l’intégration s’est faite à l’intérieur de ce gène
Exemple de l'antithrombine III recombinante
[15];[7];[9];[8];[4]
L'antithrombine III est une protéine produite au niveau du foie et de cellules endothéliales chez l’homme. Son rôle est d’empêcher la formation de caillots sanguins dans les veines et les artères. La diminution des taux d'antithrombine III entraîne un risque de maladie thrombo-embolique. Les déficiences en antithrombine peuvent venir de problèmes congénitaux ou être acquises au cours de la vie. De nos jours, avec les progrès de la science, il est possible de la synthétiser grâce au génie génétique.
Comment obtenir l’antithrombine III avec le génie génétique ?
Dans un premier temps, il faut choisir un promoteur actif dans les tissus ou les glandes dans lesquelles nous souhaitons récupérer la protéine recombinante (ici, le lait de chèvre). Ce promoteur doit être cloné. Pour que la protéine soit bien présente dans le lait, il faut que la séquence d’ADN introduite soit composée :
- D’un promoteur actif dans les glandes mammaires.
- Du gène codant pour la protéine d’intérêt
- D’un signal de polyadénylation
- Pour que l’antithrombine soit sécrétée dans le lait, il est aussi nécessaire d’introduire une séquence signal d’excrétion.
Une fois cette étape terminée, la transgenèse est réalisée comme décrit précédemment. Enfin la protéine est purifiée puis commercialisée (par exemple, sous le nom d’ATryn®).
Cette technique permet d’obtenir des quantités d’antithrombine beaucoup plus importantes que dans le sang humain.
Comment est administré le traitement ?
Il existe deux façons d'administrer cette substance :
- Par voie intraveineuse
- Sous forme de comprimés.
Notes et références
- Glossaire de la biotechnologie pour l'alimentation et l'agriculture, www.fao.org, consulté le 7 janvier 2011.]
- Louis Marie HOUDEBINE, “transgenic animal bioreactors”, 2000 Transgenic research 9.
Bilbiographie
- [2] Isabelle Collin cvc, Le génie génétique, « les animaux transgéniques », édition les Essentiels milans, 1999, pages 32-33
- [3] Isabelle Collin cvc, Le génie génétique, « la technologie du clonage », édition les Essentiels milan, 1999, pages 18-19
- [4] Académie des sciences, rst n° 14, février 2003, «protéines médicaments » Jean Hugues TROUVIN et Kowid HO, in De la transgénèse animale à la biothérapie chez l’homme, édition tec & doc, p116 à 139
- [5] Académie des sciences, rst n° 14, février 2003, « transgénèse chez la souris » Charles BABINET, in De la transgénèse animale à la biothérapie chez l’homme, édition tec & doc, , p4 à 6 et p10
- [6] Produire une protéine recombinante Principes et Méthodes de Biologie Moléculaire, Gabrielle Potocki-Veronese, INSA-Laboratoire Biotechnologie-Bioprocédés, Toulouse, Équipe Ingénierie Enzymatique Moléculaire, http://www.inra.fr/gdr-biopolymeres/pointpdf/pdfversailles/produireproteinerecombinante.pdf visité le 07/04/2010
- [7] « Les protéines recombinantes issues du lait de chèvres clonées », http://www.agribionet.org/client/page1.asp?page=1945&clef=19&clef2=11 , visité le 25/05/2010
- [8] « Antithrombine III », Dr Marie-Françoise Odou, http://www.doctissimo.fr/html/sante/analyses/sa_723_thrombineIII.htm visité le 26/05/2010
- [9] « Le premier médicament OGM autorisé en Europe », Le figarohttp://www.lefigaro.fr/sciences/20061011.FIG000000056_le_premier_medicament_ogm_autorise_en_europe.html , visité le 26/05/2010.
- [10] « Animal transgénique », in wikipédia, http://fr.wikipedia.org/wiki/Animal_transg%C3%A9nique visité le 9/05/2010
- [11] « Historique sur le génie génétique », http://svtr.blogg.org/date-2008-02-04-billet-751843.html visité le 07/04/2010
- [12] « Systèmes de production de protéines recombinantes », http://admi.net/evariste/100tc/1996/f018.html visité le30/04/2010
- [13] Protéines recombinantes en système hétérologue,http://www.univ-bpclermont.fr/FORMATIONS/Licence/chimie/UE/36BIOF22/III)%20Proteines%20recombinantes.pdf visité le 12/04/2010
- [14] « Protéines recombinantes et applications », PETRES Stéphane , BARA JAcques , GODEAU François http://www.canal-u.tv/producteurs/biotv/dossier_programmes/biotechnologies/proteines_recombinantes_et_applications, regardée le 22/04/2010
- [15] “ATryn® - RECOMBINANT HUMAN ANTITHROMBIN”, ATryn® Press Release Archive, http://www.gtc-bio.com/products/atryn.html. Visité le 3/05/2010
- [16] James WATSON, Tania BAKER, Stephen BELL, Alexander GANN, Michael LEVINE, Richard LOSICK, Biologie moléculaire du gene, edition Pearson Education France, 6e édition, 2009
- [17] http://www.inspection.gc.ca/francais/sci/ahra/bioanima/appf.shtml , visité le 22/04/2010
- Portail de la biologie cellulaire et moléculaire
Wikimedia Foundation. 2010.