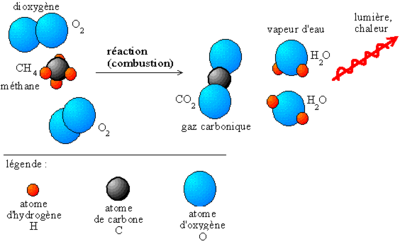
- Énergie chimique
-
Réaction chimique
Une réaction chimique est une transformation de la matière au cours de laquelle les espèces chimiques (atomiques, ioniques ou moléculaires) qui constituent la matière sont modifiées : les espèces qui sont consommées sont appelées réactifs. Les espèces formées au cours de la réaction sont appelées produits (de réaction). Depuis les travaux de Lavoisier (1777), les scientifiques savent que la réaction chimique se fait sans variation mesurable de la masse : « Rien ne se perd, rien ne se crée, tout se transforme » qui traduit la conservation de la masse.
Les réactions chimiques provoquent un changement de la nature chimique de la matière, sont donc exclues les transformations purement physiques, comme les changements d'état (fusion, solidification, évaporation, ébullition...), l'usure et l'érosion, la rupture... Une réaction peut dégager de l'énergie (en général sous forme de chaleur, mais aussi de la lumière), elle est alors dite « exothermique ». Elle peut nécessiter un apport d'énergie, sous forme de chaleur (donc « produire du froid ») ou de lumière, elle est alors dite « endothermique ». D'une manière générale, une réaction ne peut avoir lieu que si certaines conditions sont réunies (présence de tous les réactifs, conditions de température, de pression, de lumière). Certaines réactions nécessitent ou sont facilitées par la présence d'une substance chimique appelée catalyseur. Classiquement, les réactions chimiques impliquent des changements qui concernent le mouvement des électrons, la formation et la rupture des liaisons chimiques. Cependant,le concept général d'une réaction chimique, en particulier la notion d'équation chimique, est aussi applicable aux transformations élémentaires des particules et des réactions nucléaires. En chimie organique, diverses réactions chimiques sont combinées dans la synthèse chimique afin d'obtenir le produit désiré. En biochimie, des séries de réactions chimiques catalysées par des enzymes forment les voies métaboliques, par lesquelles des synthèses et les décompositions d'habitude impossibles sont exécutées dans une cellule.
Sommaire
Vision microscopique (au niveau atomique)
La matière est composée d'atomes regroupés dans des composés chimiques, au cours d'une réaction chimique, les composés s'échangent leurs atomes ; ce faisant, la nature des composés change. Les réactions chimiques ne concernent que les changements de liaisons entre les atomes (liaisons covalentes, liaisons ioniques, liaisons métalliques).
Pour représenter les phénomènes qui ont lieu au cours d'une réaction chimique, on écrit une équation chimique.
Réaction chimique et énergie
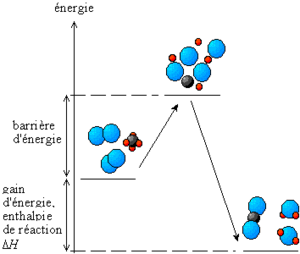
Les transformations ayant lieu lors de la réaction chimique entraînent en général, une diminution de l'énergie totale. En effet, dans une molécule ou un cristal, l'«accrochage» des atomes entre eux nécessite de l'énergie, appelée énergie de liaison. Lorsque l'on rompt une liaison, on « casse » la molécule ou le cristal en « éparpillant » ses atomes. Il faut alors fournir de l'énergie. Lorsque les atomes se recombinent, ils libèrent de l'énergie en formant de nouvelles liaisons. À la fin de la réaction, l'énergie stockée dans les liaisons des produits de réaction est plus faible que celle qui était stockée dans les liaisons des réactants.
Au cours de la réaction, il y a un stade où les anciennes liaisons sont rompues et les nouvelles ne sont pas encore créées. C'est un état où l'énergie du système est élevée, un état transitoire qui constitue une véritable barrière à la réaction. L'amorçage de la réaction consiste tout simplement à faire franchir cette barrière énergétique, appelée énergie d'activation.
Si l'on considère une réaction s'effectuant à la température T et à pression constante; ce qui est le lot des réactions effectuées à l'air libre sous la pression atmosphérique, on mesure l'énergie du système réactionnel par la fonction enthalpie: H. La différence d'enthalpie associée à l'équation de réaction, appelée enthalpie de réaction: ΔrH, permet de déterminer la variation de l'énergie du système après réaction. Elle s'exprime le plus souvent par un transfert thermique avec le milieu extérieur.
L'étude de l'aspect énergétique des réactions chimiques est la thermochimie.
Vitesse de réaction
Article détaillé : Cinétique chimique.L'étude de l'énergie du système (thermochimie) permet de savoir si une réaction peut se produire ou non, quelle énergie initiale il faut fournir pour franchir la barrière. Mais il y a un autre paramètre important : la vitesse de réaction.
La vitesse de réaction est la mesure de la modification avec le temps des concentrations ou/et pressions des substances engagées dans cette réaction. L'analyse des vitesses de réaction est importante pour beaucoup d'applications comme l'ingénierie chimique ou l'étude des équilibres chimiques.
La vitesse de réaction dépend de :
- La concentration des réactifs: une plus grande concentration augmente la possibilité de collision entre les molécules et ainsi augmente la vitesse de réaction.
- La surface disponible pour le contact entre les molécules spécialement du solide dans les systèmes hétérogènes. Une plus grande surface produit une plus grande vitesse de réaction.
- La pression, qui en augmentant, diminue le volume et donc la distance entre les molécules. Cela augmente la fréquence des collisions des molécules.
- L'énergie d'activation qui est définie comme la quantité d'énergie nécessaire pour que la réaction débute et s'entretienne spontanément.
- La température qui en s'élevant active la réaction augmentant l'énergie des molécules et créant plus de collisions par unité de temps
- L'absence ou la présence d'un catalyseur qui modifie le mécanisme de la réaction qui, à son tour, augmente la vitesse de la réaction abaissant l'énergie d'activation nécessaire. Un catalyseur n'est pas détruit durant la réaction.
- Pour certaines réactions, la présence de radiations électromagnétiques , spécialement les radiations ultraviolettes, sont nécessaires pour briser des liaisons pour commencer la réaction.
Notons que certaines réactions ne dépendent pas de la concentration des réactifs.
Exemples de réactions chimiques
Parmi les réactions chimiques les plus courantes, citons :
- la respiration, la fermentation lactique et la fermentation alcoolique qui permettent aux organismes de produire de l'énergie
- la sécrétion de produits par les organes (larmes, sueurs, salive, sucs gastriques, hormones...), l'action de ces sécrétions
- la combustion (entre autres dans les moteurs à explosion et les chaudières), le feu
- la cuisson des aliments, les brûlures
- la corrosion de la matière (par exemple la rouille)
- la photosynthèse chlorophylienne qui permet aux plantes de régénérer le dioxygène de l'air en récupérant le dioxyde de carbone
- la dissolution des métaux par l'acide
- la révélation des photographies
- la fabrication d'électricité par les piles, le stockage et la libération d'électricité par les batteries et accumulateurs
- l'élaboration des métaux à partir des minerais (métallurgie)
- la fabrication de l'essence, des huiles et des plastiques à partir du pétrole
- la fabrication des produits d'entretien : savon (réaction de saponification), eau de Javel, acide chlorhydrique, soude caustique, ammoniaque
- la fabrication d'engrais, pesticides, produits phytosanitaires...
- la fabrication des médicaments
- la vinification, la transformation alcool → acide éthanoïque (vinaigre)
- le « virage au vert » de l'alcootest
- la pollution à l'ozone à partir des polluants atmosphériques
- la destruction de l'ozone par les composés chlorofluorocarbonés (CFC, fréons)
Types de réaction
La grande diversité des réactions chimiques et les manières d'en interpréter les résultats qui souvent se chevaucher fait qu'il y a diverses manières de les classifier.
Voici des exemples de termes très utilisés pour décrire les types communs de réactions:
- Isomérisation, dans laquelle un composé chimique subit une remise en ordre structurale sans aucun changement de sa composition atomique nette .
- Combinaison directe ou synthèse, dans laquelle deux ou plus éléments chimiques ou des composés s'unissent pour former un produit plus complexe : N2 + 3 H2 → 2 NH3
- Décomposition chimique dans laquelle un composé est scindé en plus petits composés ou éléments : 2 H2O → 2 H2 + O2
- Simple déplacement ou substitution où un élément est déplacé d'un composé par un élément plus réactif : 2 Na(s) + 2 HCl(aq) → 2 NaCl(aq) + H2 (g)
- Métathèse ou double substitution, dans laquelle deux composés échangent des ions ou des liaisons pour former différents composés : NaCl(aq) + AgNO3(aq) → NaNO3(aq) + AgCl(s)
- Réactions acide-base largement caractérisées comme réactions entre un acide et une base. Elles peuvent avoir différentes définitions selon le concept d'acide-base utilisé. Les plus communes sont :
- Définition d'Arrhenius : Les acides se dissocient dans l'eau libérant des ions H3O+ ; les bases se dissocient dans l'eau libérant des ions OH-.
- Définition de Brønsted-Lowry : Les acides sont des donneurs de proton (H+) ; les bases sont des receveurs de proton.(inclus dans la définition d'Arrhenius)
- Définition de Lewis : Les acides sont des receveurs de paires d'électrons ; les bases sont des donneurs de paires d'électrons. (inclus dans la définition de Brønsted-Lowry)
- Réactions rédox, dans lesquelles il y a des changements du nombre d'oxydation des atomes impliquées. Ces réactions peuvent souvent être interprétées comme des transferts d' électrons entre différents emplacements ou espèces moléculaires. Un exemple typique de réaction redox est
- 2 S2O2-(aq) + I2(aq) → S4O62-(aq) + 2 I-(aq) dans laquelle I2 est réduit en I- et S2O32- (anion thiosulfate) est oxydé en S4O62-.
- La combustion est un genre de réactions redox dans laquelle n'importe quelle substance combustible combine avec un élément oxydant, habituellement l'oxygène, pour produire de la chaleur et pour former les produits oxydés. Le terme combustion est habituellement employé seulement pour l'oxydation à grande échelle des molécules entières. Une oxydation contrôlée d'un seul groupe fonctionnel n'est pas une combustion.
C10H8+ 12 O2 → 10 CO2 + 4 H2O CH2S + 6 F2 → CF4 + 2HF + SF6
- Réactions organiques comprennent un grand éventail de réactions impliquant les composés qui ont le carbone comme élément principal en leur structure moléculaire. Les réactions auxquelles un composé organique peut participer sont en grande partie définies par ses groupes fonctionnels.
Les réactions peuvent également être classifiées en fonction de leur mécanisme, quelques exemples typiques :
- Réactions d'ions, par exemple dismutation de l'hypochlorite de sodium
- Réactions avec un ion réactif intermédiaire par exemple réactions d'énolates
- Réactions radicalaires, par exemple combustion à hautes températures
Voir aussi
Articles connexes
- Chimie
- Cinétique chimique
- Équation chimique
- Formule chimique
- Liste des réactions chimiques
- Équilibre chimique
- Portail de la chimie
Catégorie : Réaction chimique
Wikimedia Foundation. 2010.