- État de la matière
-
En physique, un état de la matière correspond à un certain degré de cohérence de la matière (densité, structure cristalline, indice de réfraction…) qui se traduit par des comportements définis par les lois de la physique (malléabilité, ductilité, viscosité, loi des gaz parfaits, etc.).
Sommaire
Différents états de la matière
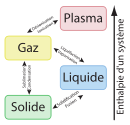
Les trois états les plus classiques de la matière sont :
Cette classification est cependant incomplète. On peut y ajouter différents états plus exotiques :
- l'état mésomorphe ou état cristal liquide, un état intermédiaire entre liquide et solide.
- le condensat de Bose-Einstein (condensation de bosons dans le niveau de plus basse énergie), par exemple : le superfluide ou le condensat de rubidium (voir refroidissement d'atomes par laser) ;
- l'état plasma (ionisation d'un gaz) ;
- l'état supercritique (équilibre liquide-gaz obtenu par augmentation de la pression) ;
- L'existence d'un état supersolide est controversée.
Mais les comportements de la matière ne sont pas toujours uniformes au sein d'un même état. Ainsi existe-t-il des états intermédiaires où l'on observe un solide se comporter comme un fluide (matière pulvérulente ou granuleuse) ou au contraire un liquide avoir certaines propriétés propres aux solides. Ces comportements peuvent être issus de mélanges plus ou moins intimes entre plusieurs phases, appelés états polyphasiques (émulsions, ...).
On peut aussi rencontrer la matière dans un état hors équilibre thermodynamique ; les propriétés du matériau dépendent alors du temps, car le matériau se relaxe, sans jamais atteindre l'équilibre thermodynamique. Tout matériau spatialement hétérogène va rentrer dans cette définition dans la mesure où ces hétérogénéités spatiales vont se traduire par des contraintes internes impliquant ainsi un état non stable thermodynamiquement. Néanmoins, les temps de relaxation de tels systèmes peuvent atteindre des durées tellement longues qu'ils sont inobservables expérimentalement (allant jusqu'à plusieurs dizaines de milliers d'années).
Parmi ces matériaux on trouve de nombreux systèmes de la matière molle, ni solide, ni liquide tels que les verres, les gels ou bien les pâtes. Il n'est plus alors possible de parler de diagramme de phase (faisant référence à un état de la matière thermodynamiquement stable), le terme employé alors étant celui de diagramme d'état. Des diagrammes d'état unifiant les comportements des systèmes encombrés ont été établis pour de nombreux systèmes avec des interactions de type répulsif (granulaire, verres avec interaction de type volume exclu…) par Liu et Nagel en 1998, ainsi que pour les systèmes avec interaction de type attractif par Trappe, Prasad, Cipelletti, Segre, et Weitz, en 2001.
États classiques de la matière
État solide
L’état solide est caractérisé par l'absence de liberté entre les molécules ou les ions (métaux par exemple).
Les critères macroscopiques de la matière à l'état solide sont :
- le solide a une forme propre,
- le solide a un volume propre.
État liquide
L'état liquide est un état de la matière. Sous cette forme, la matière est facilement déformable mais difficilement compressible.
Le liquide est une forme de fluide : les molécules y sont faiblement liées, ce qui rend les liquides parfaitement déformables. Mais, à l'inverse du gaz, elles sont tout de même liées.
État gazeux
Dans l’état gazeux, la matière n'a pas de forme propre ni de volume propre : un gaz tend à occuper tout le volume disponible.
Wikimedia Foundation. 2010.