- Parabène
-
Un parabène est un parahydroxybenzoate d'alkyle, c'est-à-dire un ester résultant de la condensation de l'acide parahydroxybenzoïque avec un alcool. Ses propriétés antibactérienne et antifongique font qu'il est généralement utilisé comme conservateur dans les cosmétiques, les médicaments et les aliments.
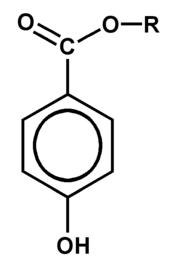
La structure générale d'un parabène étant donnée par l'illustration ci-contre, les différents composés de cette famille diffèrent par la nature du groupe alkyle R .
En 2010, l'utilisation de parabènes porte à controverse en raison de leur capacité à activer les récepteurs des œstrogènes, induisant une possible action sur la fertilité et les tumeurs œstrogéno-dépendantes, comme le cancer du sein. Le 3 mai 2011, l'Assemblée nationale a adopté une proposition de loi interdisant l'utilisation du parabène en France[1].
Sommaire
Chimie
Les composés de la famille des parabènes utilisés dans l'industrie sont :
- le méthylparabène ou 4-hydroxybenzoate de méthyle (E218) et son sel de sodium (E219) ;
- l'éthylparabène ou 4-hydroxybenzoate d'éthyle (E214) et son sel de sodium (E215) ;
- le propylparabène ou 4-hydroxybenzoate de propyle (E216) et son sel de sodium (E217) ;
- l'isopropylparabène ;
- le butylparabène ;
- l'isobutylparabène ;
- le benzylparabène.
Parabènes naturels
Les parabènes existent aussi à l’état naturel dans certains aliments tels que la mûre, l'orge, la fraise, le cassis, la vanille, la carotte ou l'oignon, des aliments préparés à partir de plante (jus de raisin, autres jus, vinaigre de vin...) et certains fromages. On les trouve également dans les produits fabriqués par les abeilles (propolis, gelée royale...). Ils sont aussi naturellement présents dans le corps humain (précurseur du coenzyme Q10)[2].
Utilisation
Du fait de leur activité effective antibactérienne et antimycosique, ils sont utilisés comme conservateurs dans des aliments, des boissons, des cosmétiques et des produits pharmaceutiques[3]. On les retrouve dans plus de 80 % des produits d'hygiène et de toilette dont des shampooings, des crèmes hydratantes, mousses à raser, gels nettoyant...
L’activité antimicrobienne augmente en fonction de la longueur de la chaîne carbonée de l'alcool estérifié du parabène ; mais les plus utilisés sont le méthylparabène et le propylparabène du fait de leur plus grande solubilité et parce qu'ils possèdent un effet synergique[4].
Des additifs spécifiques comme le méthylparabène sont ajoutés aux anesthésiques locaux pour augmenter l’activité antibactérienne. Ils sont ajoutés pour limiter la contamination par l’entrée de différents vials[réf. nécessaire].
Le méthylparabène est le conservateur le plus utilisé dans l’anesthésie locale. À l’état pur, il est incolore et n’est pas affecté par la chaleur ou le froid. Les solutions de méthylparabène sont stables à un pH entre 3 et 6, mais ils sont hydrolysés dans un environnement alcalin. Le propylparabène a des propriétés similaires. Ces conservateurs ne remplacent pas les techniques de stérilisation mais aident seulement à diminuer la charge microbiologique[5].
Le méthylparabène (poudre solide) est aussi utilisé comme plastifiant pour certains médicaments à cause de ses propriétés semi-conductrices[réf. nécessaire]. Il permet de contrôler le dégagement des médicaments à base de polymère et faciliter le processus thermique. Les plastifiants sont importants pour diminuer la température vitreuse (Tg) et ramollir les médicaments polymères durant son extrusion. Alors la Tg du polymère diminue en augmentant la quantité du méthylparabène, ceci est dû à l’augmentation de la mobilité de chaînes des molécules du polymère quand le méthylparabène est inséré dans la matrice. Tout cela se passe sous haute température[6].
Toxicité
Du fait de leur emploi comme conservateur dans plusieurs produits cosmétiques et pharmaceutiques, l'être humain est régulièrement exposé aux parabènes. Leur utilisation dans plus de 13 000 formules cosmétiques, ainsi que leur capacité à pénétrer à travers la peau[7] posent la question de leur toxicité.
D'après l'AFSSAPS (Agence Française de Sécurité Sanitaire des Produits de Santé), les parabènes sont généralement bien tolérés dans les médicaments, donc par voir orale. L'association de méthylparaben et de propylparaben (qui permet de diminuer les doses respectives des deux composés) est la plus souvent utilisée[8].
Des études récentes montrent cependant que les parabènes sont capables d'établir des liaisons avec les récepteurs aux œstrogènes. Cependant, la réponse provoquée par les parabènes serait de 100 000 à 1 million de fois plus faible que la réponse physiologique au 17β-œstradiol[8]. Cette caractéristique conduit à deux risques : une baisse de la fertilité pour l'homme, et une promotion de tumeurs œstrogéno-dépendantes.
Des études aux résultats contradictoires ayant été publiées concernant l'effet sur la fertilité et le potentiel cancérigène, des recherches sont toujours en cours en 2010 pour déterminer un risque avéré dans l'utilisation médicamenteuse des parabènes, et des seuils de toxicité[8]. Le débat scientifique à propos de leur toxicité et de leurs effets cancérigènes pousse l'Assemblée Nationale à voter leur interdiction le 3 mai 2011[9].
D’après le groupe scientifique sur les additifs alimentaires, les arômes, les auxiliaires technologiques et les matériaux en contact avec les aliments (groupe scientifique AFC) :
« Plusieurs parabènes ont montré une activité œstrogénique in vitro. Cependant, aucune activité œstrogène n'a pu être détectée in vivo pour le méthyl parabène, l'éthyl parabène et le propyl parabène au cours d'essais utérotrophiques classiques sur la base d'administrations, per os ou sous-cutanée, de fortes doses à des souris et des rats. Un effet utérotrophe in vivo a été observé après l'injection sous-cutanée de butyl parabène ou d'isobutyl parabène, qui ne sont pas utilisés comme additifs alimentaires. Le métabolite commun des parabènes, l'acide p-hydroxybenzoïque, a été considéré comme non-œstrogénique.
— EFSA[10] »L’AFSSAPS a ainsi indiqué le 29 septembre 2005 que : « La commission de cosmétologie s’est prononcée favorablement à la poursuite de l’utilisation, aux conditions prévues par la réglementation actuelle, de quatre des cinq parabènes les plus couramment utilisés (méthyl, éthyl, propyl et butyl parabènes). »
Exposition au Soleil
Des études indiquent que le méthylparabène, appliqué sur la peau à une concentration telle qu'on le trouve dans les produits cosmétiques, accélère le vieillissement cutané et augmente les dommages subis par l'ADN si la peau est exposée au Soleil[11],[12].
Une alternative aux parabènes
En raison des nombreux doutes qui planent quant à l’innocuité des conservateurs en cosmétique, le nouvel enjeu est de formuler « sans conservateur ». Les conservateurs apparaissent pourtant comme indispensables à la protection des cosmétiques, étant donné qu'ils servent à éviter le développement de bactéries et de champignons qui se développent plus facilement dans un milieu aqueux. Un laboratoire s’est donc intéressé au principe de la stérilisation UHT du lait pour l’appliquer aux cosmétiques. Utilisé au quotidien pour le lait, ce procédé consiste à chauffer le produit à très haute température puis de le refroidir immédiatement pour éviter l’apparition de bactéries. Cette méthode permet d’éviter de recourir aux conservateurs[13].
Depuis la fin des années 1970, une autre méthode a permis au laboratoire Beiersdorf d'enlever les conservateurs de la crème Nivea bleue : la crème est toujours une émulsion d'eau dans l'huile mais la taille des gouttes d'eau dispersées dans l'huile a été réduite. De cette façon, les germes et les bactéries qui ont besoin d'eau pour leur développement sont cernés d'huile et arrêtent de se multiplier par manque d'eau[14].
La vitamine E est de plus en plus utilisée dans les cosmétiques de type huile dans eau (savon liquide, gel douche, crème de soin), comme conservateur grâce à son action antioxydante, pouvant être associée, avec de l'extrait de pépin de pamplemousse, pour la partie aqueuse de ces émulsions.
Enfin, notons que certaines huiles essentielles naturelles sont déjà utilisées comme agents conservateurs. Celles-ci peuvent également poser des problèmes (notamment d'allergies) mais les risques pour la santé sont moins grands qu'avec les conservateurs synthétiques[14].
Analyse
La détection et le dosage des parabènes peut être effectué par plusieurs techniques et méthodes comme la chromatographie en phase liquide à haute performance (HPLC), l'électrophorèse capillaire et l'analyse par injection en flux continu (en) (FIA).
La méthode de chromatographie liquide à haute performance (HPLC) en phase inverse est utilisée pour analyser les méthylparabènes (MP) et propylparabènes (PP). La séparation par chromatographie liquide de ces conservateurs peut se faire avec les conditions suivantes :
- colonne de type C-18 (125x4-mm ID) ;
- phase mobile - eau acidifiée (ex. acide phosphorique 0,02M ou solution tampon) / méthanol (ou acétonitrile) avec un gradient d'élution ;
- débit de 1,0 mL/min[15].
- détection avec un spectromètre ultraviolet-visible à 254 nm mais un détecteur électrochimique peut aussi donner de bons résultats (exemple de ce dernier : voltampéromètre cyclique.)[15],[16].
Le temps de rétention du méthylparabène est de trois à minutes ; celui du propylparabène se situe entre huit et dix minutes. Ce dernier dépend du pH et du gradient[17],[18].
La FIA est plus rapide et moins onéreuse que la HPLC mais sa résolution est plus faible. Celle-ci reste cependant suffisante pour de nombreuses analyses[19].
Notes et références
- http://www.lefigaro.fr/flash-actu/2011/05/03/97001-20110503FILWWW00600-l-assemblee-interdit-les-phtalates.php
- http://ressources.ensp.fr/memoires/2009/persan_igs/parabens.pdf
- S.H. Kang, H. Kim, J.Pharm. Biomed. Anal, 15 (1997)1359
- D.m. Kreuz. A.L. Howard, D. Ip, J. Pharm. Biomed. Anal. 19 (1999) 725
- : M.G. Reichert, J. Butterqorth, Techniques in Regional Anesthesia and Pain Management, vol 8, No3 (july), 2004 : pp 106-109.
- C. Wu, J.W. McGinity, European Journal of Pharmaceutics and Biopharmaceutics, 56 (2003) 95-100.
- J.R. et al., Journal of Steroid Biochemistry & Molecular Biology 80 (2002) 49-60
- Bulletin de l'AFSSAPS, mars 2009
- [1].
- (fr) « Avis du groupe scientifique sur les additifs alimentaires, les arômes, les auxiliaires technologiques et les matériaux en contact avec les aliments à la demande de la Commission concernant les para hydroxybenzoates (E 214-219) », 13 juillet 2004, EFSA
- O.H. et al. Methylparaben potentiates UV-induced damage of skin keratinocytes, ScienceDirect, Toxicology, Volume 227, Issues 1-2, 3 octobre 2006, pages 62-72
- Y.o. et al. Combined Activation of Methyl Paraben by Light Irradiation and Esterase Metabolism toward Oxidative DNA Damage, Chem. Res. Toxicol., 26 juillet 2008, 21 (8), pp 1594–1599
- (fr)L'innovation de Dermatherm pour des soins sans conservateurs, expertise.mademoiselle-bio.com
- cosmétiques : la chimie dans la peau (émission "à bon entendeur" diffusé sur la TSR, le 3 mai 2005)
- S.H. Kang, H. Kim, J. Pharm. Biomed. Anal. 15 (1997)1359-1363
- R. Hajkova, P. Solich, J. Dvorak, J. Sicha, J. Pharm. Biomed. Anal. 32 (2003) 921-927
- M.D. Kreuz, A.L. Howard, D. Ip, J. Pharm. Biomed. Anal. 19 (1999) 725-730
- R. Hajkova, P. Solich, J. Dvorak, J. Sicha, J. Pharm. Biomed. Anal. 32 (2003) 921-927
- J.F. Garcίa-Kiménez et al. / Analytical Chimica Acta 594 (2007) 226-233.
Annexes
Articles connexes
Liens externes
- (fr) Les parabènes au quotidien, article scientifique École Normale Supérieure - DGESCO
- Avis du groupe scientifique AFC concernant les para hydroxybenzoates (E 214-219) 1 Dec 2004
- Septième directive de la commission relative aux méthodes d'analyse nécessaires au contrôle de la composition des produits cosmétiques
- Monographie sur les parabènes
Wikimedia Foundation. 2010.