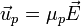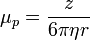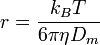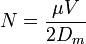- Electrophorese capillaire
-
Électrophorèse capillaire
L'électrophorèse capillaire (en anglais capillary electrophoresis : CE) peut être utilisée pour séparer des espèces ioniques selon leur charge et les forces de friction qui s'exercent sur elles.
En électrophorèse traditionnelle, les éléments chargés électriquement se déplacent dans le liquide conducteur sous l'influence d'un champ électrique. Introduite dans les années 1960, la CE a été conçue pour séparer des espèces chimiques selon leur rapport taille / charge à l'intérieur d'un petit tube capillaire rempli d'un électrolyte.
Sommaire
Instrumentation
L'appareillage nécessaire pour réaliser des électrophorèses capillaires est relativement simple (figure 1). Les principaux composants du système sont un flacon d'échantillon, deux flacons source et destination, un capillaire, des électrodes, une source de courant haute tension, un détecteur, et un appareil de récupération et de traitement des données.
Les flacons source et destination ainsi que le capillaire sont remplis avec un électrolyte tel qu'une solution aqueuse de tampon. Pour introduire l'échantillon, l'extrémité du capillaire est placée dans le flacon contenant l'échantillon, puis est replacée dans le flacon source (l'échantillon est injecté dans le capillaire par capillarité, pression, siphonage ou électro-injection).
La migration des analytes se met alors en place grâce à un champ électrique appliqué entre les flacons source et destination, et fourni aux électrodes par le générateur haute tension. Tous les ions, positifs ou négatifs, sont attirés à travers le capillaire dans le même sens par le flux électroosmotique (voir plus loin).Les analytes sont séparés pendant leur migration du fait de leurs mobilités électrophorétiques différentes (voir plus loin), et sont détectés à proximité de la sortie du capillaire. Le signal du détecteur est envoyé à un appareil qui reçoit et traite ces données, tel qu'un intégrateur ou un ordinateur. Les données sont affichées sous la forme d'un électrophorégramme, qui donne la réponse du détecteur en fonction du temps. Les composés chimiques séparés apparaissent comme des pics avec des temps de rétention différents sur l'électrophorégramme[1].
Détection
La majorité des systèmes commerciaux utilisent la détection par UV-Vis (Absorbance). Dans ce type de système une section du capillaire est utilisée comme cellule de détection. La détection directement à l'intérieur du capillaire permet l'analyse des solutés sans perte d'efficacité.
La détection par fluorescence peut également être utilisé en ajoutant un module extérieur à l'appareil commercial. Ce mode de détection est beaucoup plus sensible et sélectif. En effet, seul les molécules naturellement fluorescente ou chimiquement dérivées peuvent donner un signal.
L'électrochimie peut aussi être utilisé comme mode de détection soit en amperométrie ou en coulométrie. ce mode de détection est plus sensible et plus sélectif que l'UV-Vis.
Le couplage à la spectrometrie de masse est également possible afin d'effectuer l'identification des composés séparés.
Modes de séparation
La séparation des composants par électrophorèse capillaire dépend de la migration différentielle des analytes dans un champ électrique appliqué. La vitesse de migration électrophorétique (up) d'un analyte vers l'électrode de charge inverse est :
où μp est la mobilité électrophorétique et E la force du champ électrique.
La mobilité électrophorétique est proportionnelle à la charge ionique de l'échantillon et inversement proportionnelle à toute force de friction présente dans le tampon. Lorsque deux espèces moléculaires dans l'échantillon ont des charges différentes ou subissent des forces de friction différentes, elles seront séparées l'une de l'autre lors de leur migration à travers la solution tampon. Les forces de friction que subit un analyte dépendent de la viscosité (η) du milieu et de la taille et forme de cet ion. De cette façon, la mobilité électrophorétique d'un analyte à un pH donné est :
où z est la charge nette de l'analyte et r est son rayon de Stokes. Le rayon de Stokes est donné par la formule :
où kB est la constante de Boltzmann, T est la température absolue en kelvin et Dm est le coefficient de diffusion de l'analyte.
Efficacité et résolution
Le nombre de plateaux théoriques, ou efficacité, en électrophorèse capillaire est donné par :
où N est le nombre de plateaux théoriques, μ est la mobilité apparente et Dm est le coefficient de diffusion de l'analyte. Selon cette équation, l'efficacité de la séparation est seulement limitée par la diffusion et est proportionnelle à l'intensité du champ électrique. L'efficacité des séparations en électrophorèse capillaire est généralement plus grande que celle d'autres méthodes de séparation telle que l'HPLC. Contrairement à l'HPLC, l'électrophorèse capillaire n'implique pas de transfert de masse entre les phases. De plus, le profil d'écoulement du flux est plat, alors qu'il est parabolique pour un flux hydrodynamique : il n'y a donc pas élargissement du pic comme en HPLC.
Techniques liées
La séparation des analytes en électrophorèse capillaire est possible seulement pour les composés chargés. Il existe cependant une méthode permettant la séparation des composés neutres. Pour cela on ajoute un tensio-actif afin de créer des micelles avec les différents analytes qui pourront alors être séparés.
Une autre solution peut être l'utilisation de phase stationnaire, on parle alors d'électrochromatographie. Cette phase stationnaire peut être sous la forme de particules de granulométrie contrôlée ou bien de monolithe.
Appareils employant l'électrophorèse capillaire
Références
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Capillary electrophoresis ».
- ↑ Skoog, D.A.; Holler, F.J.; Crouch, S.R "Principles of Instrumental Analysis" 6th ed. Thomson Brooks/Cole Publishing: Belmont, CA 2007.
Références non citées en ligne:
- Terabe, S.; Otsuka, K.; Ichikawa, K.; Tsuchiya, A.; Ando, T. Anal. Chem. 1984, 56, 111.
- Terabe, S.; Otsuka, K.; Ichikawa, K.; Tsuchiya, A.; Ando, T. Anal. Chem. 1984, 56, 113.
- Foley, J.P. Anal. Chem. 1990, 62, 1302.
- Carretero, A.S.; Cruces-Blanco, C.; Ramirez, S.C.; Pancorbo, A.C.; Gutierrez, A.F. J. Agric. Food. Chem. 2004, 52, 5791.
- Cavazza, A.; Corradini, C.; Lauria, A.; Nicoletti, I. J. Agric. Food Chem. 2000, 48, 3324.
- Rodrigues, M.R.A.; Caramao, E.B.; Arce, L.; Rios, A.; Valcarcel, M. J. Agric. Food Chem. 2002, 50, 425.
Catégories : Chromatographie | Électrophorèse | Électrochimie
Wikimedia Foundation. 2010.