- Green rust
-
Structures cristallines des hydroxydes, oxy-hydroxydes et oxydes de fer
Les composés oxygénés de fer divalent ou trivalent sont très répandus dans la nature. Ce sont des matériaux extrêmement importants pour de nombreuses industries, du fait de leur non-toxicité et de leur bas coût de production : pigments inorganiques naturels (utilisés dès la préhistoire, ocre rouge…); minerais pour la sidérurgie; matériaux de base pour la constitution d’aimants permanents… Dans cet article il sera fait le tour des principaux types de structures cristallines sous lesquelles ils apparaissent et la description des relations structurales qui peuvent exister entre elles.
Il existe plusieurs façons de classer ces composés, selon le nombre d'oxydation du fer (fer divalent, trivalent ou mixte divalent-trivalent), selon la formule chimique (oxyde, hydroxyde ou oxy-hydroxyde) et enfin selon la nature bidimensionnelle ou tridimensionnelle de la structure cristalline. C’est ce dernier critère de classement qui a été choisi de préférence, dans la mesure où l’objet de cet article est largement fondé sur l’aspect structural. Dans les figures des structures, les atomes ou les ions sont modélisés par des sphères dont le rayon correspond au rayon atomique ou ionique. Afin de visualiser clairement les enchaînements de polyèdres définis par l'environnement du fer, les rayons ioniques ont été diminués à 30% de leur valeur réelle.
Sommaire
Les composés de structure bidimensionnelle ou structure en feuillets
Rouille blanche
L'expression rouille blanche (white rust) correspond plutôt à l'oxyde de zinc. Néanmoins cette dénomination s'applique également à des composés du fer divalent.
Le plus caractéristique est l’hydroxyde de fer divalent : ß-Fe(OH)2 appelé « rouille blanche » (white rust) car il possède une couleur vert très pâle. Il présente une structure feuilletée de type brucite : ß-Mg(OH)2, rencontrée dans de nombreux hydroxydes de métaux divalents ainsi que dans des iodures, MI2. Cette phase n’existe pratiquement pas à l’état naturel et pour l’obtenir pure en laboratoire il faut impérativement se placer en atmosphère réductrice car le fer divalent s’oxyde très rapidement en fer trivalent. C’est en quelque sorte une structure limite car elle contient toujours un peu de fer trivalent.
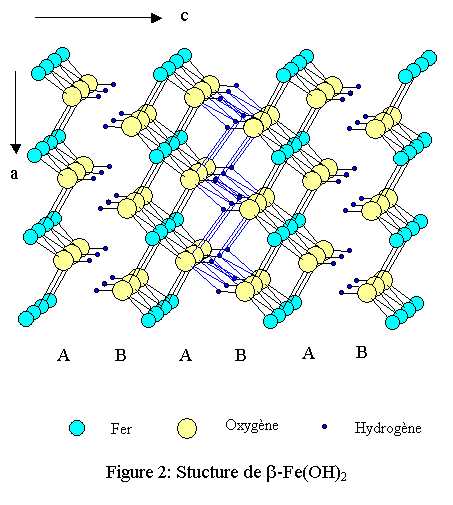
La structure appartient au système cristallin trigonal de groupe d'espace P-3m1 (n°164). Les paramètres cristallins donnés dans une maille hexagonale sont les suivants :- a = 3,265 Å ;
- c = 4,601 Å.
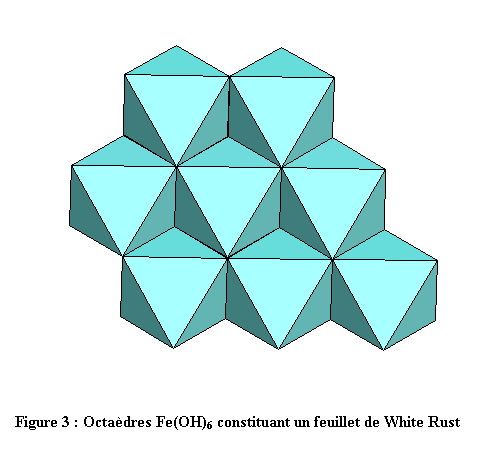
La structure est constituée d’octaèdres Fe(OH)6. Chaque ion OH- est commun à 3 fers et compte donc pour 1/3, ce qui aboutit à la formule Fe(OH)2 pour chaque feuillet. Chaque fer est en contact avec 6 fers voisins par l’intermédiaire de 6 arêtes du polyèdre de coordination. La cohésion entre les feuillets est assurée par un tissu de liaisons hydrogène relativement faibles mais nombreuses (voir figures 1, 2 et 3). L’empilement compact des oxygènes est du type hc (hexagonal compact : ABAB)[1],[2].
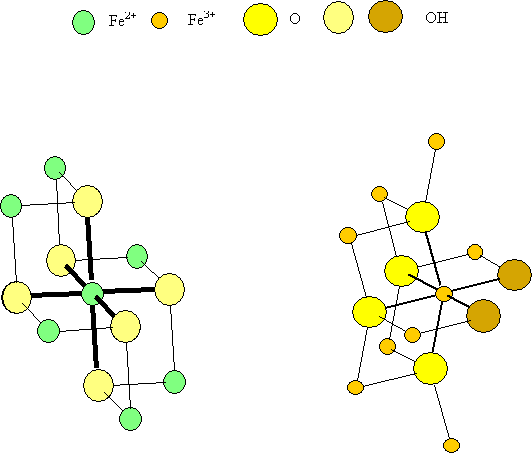
Figure 1: Environnements du fer dans la rouille blanche et la lépidocrocite
Rouilles vertes
Étant donnée l’instabilité du fer divalent en milieu oxydant, dans la nature il se forme des hydroxydes mixtes de fer divalent et trivalent appelés rouilles vertes (green rusts). Ils conservent la structure feuilletée de type brucite mais le remplacement de fer divalent par du fer trivalent implique que les feuillets ne sont plus neutres. L’excès de charge positive est alors compensé par l’introduction d’anions dans l’espace inter-feuillet, accompagnée de molécules d’eau pour assurer la cohésion par des liaisons hydrogène. Les principaux anions peuvent être Cl-, SO42-, CO32-, PO43-. Seul sera exposé le cas du chlorure GR1(Cl), dont la formule peut s’écrire :
- Fe(II)(1-x)Fe(III)x (OH)2 Clx , nH2O
avec x pouvant atteindre la valeur de 0,33. La structure est rhomboédrique de groupe d'espace R-3m (n°166). Les paramètres cristallins définis dans une maille hexagonale ont pour valeur :
- a = 3,190 Å ;
- c = 23,85 Å.
Les feuillets de type brucite, chargés positivement, [Fe(II)(1-x) Fe(III)x (OH)2]x+ alternent avec un espace inter-feuillets qui accueille les ions Cl- et des molécules d’eau. La présence d’anions dans l’espace inter-feuillets se traduit par une augmentation importante de la distance inter-feuillets par rapport à celle de ß-Fe(OH)2 (7,95 Å au lieu de 4,601 Å). De plus les feuillets sont décalés d’une valeur égale au 1/3 du paramètre a suivant cet axe, ce qui implique que le paramètre c correspond à trois espaces inter-feuillets au lieu de un dans ß-Fe(OH)2 (voir figure 4). L’empilement pseudo-compact des oxygènes OH n’est plus du type hc (ABAB) mais du type (AABBCC), une variante du type cubique à faces centrées, cfc (ABC).

Dans le cas du sulfate GR2(SO42-), la structure est un peu différente tout en conservant les feuillets de type brucite.
En 1996, un minéral de la famille des GR1 de couleur bleu verdâtre, répertorié sous le nom de fougérite a été découvert pour la première fois dans la forêt de Fougères (Bretagne, France)[3],[4],[5]. Un minéral de cette famille des rouilles vertes avait depuis longtemps été suspecté d'être la forme minéralogique du fer dans les milieux réducteurs tels les sols hydromorphes et les gleysols(en) sans toutefois avoir été identifié. En effet, la diffraction des rayons X, outil de caractérisation minéralogique par excellence, est ici inefficace à cause des faibles teneurs en fer. D'autres techniques ont été mises en œuvre afin de caractériser et d'homologuer ce minéral auprès de l' International Mineralogical Association avec le numéro suivant: IMA 2003-057[6],[7].
Lépidocrocite
Le troisième représentant des composés possédant une structure bidimensionnelle est un oxy-hydroxyde : la lépidocrocite de formule γ-FeO(OH). Cette phase solide, assez rare dans la nature se forme dans des conditions bien particulières. Généralement elle est obtenue par une oxydation rapide de la GR1(Cl).
Lorsque l’oxydation des ions Fe2+ est rapide il se produit une réorganisation à l’intérieur des feuillets, dans l’état solide (transformation topotactique), sans établissement de liaisons inter-feuillets à cause de l’effet d’écran des ions Cl- présents dans l’espace inter-feuillets. La structure feuilletée est en quelque sorte une réminiscence de la structure feuilletée du précurseur GR ; les feuillets neutres ayant pour formule [Fe(III)O(OH)][8].
La différence avec la brucite se manifeste au niveau de l’environnement du fer qui est relié à 8 atomes de fer voisins par 6 arêtes et 2 sommets (voir figures 1 et 5). Surtout un oxygène se distingue par un environnement exotique en étant relié à deux atomes de fer seulement et un hydrogène. De plus, l’empilement des oxygènes n’est plus compact dans cette phase solide qui est métastable.
La structure est orthorhombique de groupe d'espace Cmcm (n° 63). Les paramètres de la maille ont pour valeur :
- a = 3,072 Å ;
- b = 12,516 Å ;
- c = 3,873 Å.
Un désordre statistique affecte l’hydrogène, situé entre deux sites possibles proches l’un de l’autre (distance égale à 0,55 Å)[9]. La structure est représentée sur la figure 5. Elle est constituée d’octaèdres FeO4(OH)2 reliés entre eux pour donner naissance à des feuillets ondulés; la cohésion étant assurée par un réseau de liaisons hydrogène relativement fortes.
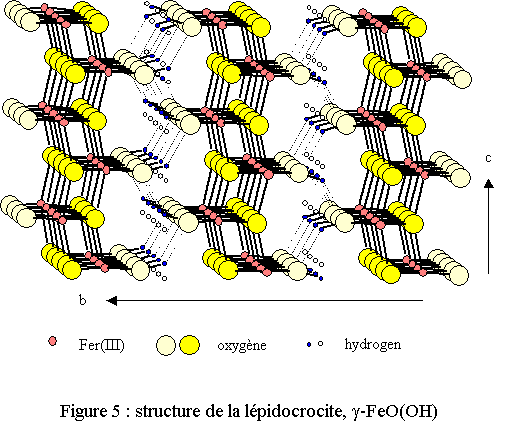
La lépidocrocite se présente sous la forme de cristaux brun-rouges mais elle possède une couleur jaune-orangée à l’état pulvérulent (lépidocrocite signifie « écaille de crocus » : couleur safran en grec). Elle se forme généralement dans la nature, dans des milieux rendus réducteurs par la présence de matière organique et de certaines bactéries tirant leur énergie de la réduction du fer trivalent. Il est en effet probable que pour la formation de la lépidocrocite le passage par un précurseur contenant du fer divalent soit indispensable.
En conclusion
Les composés à structure feuilletée présentent entre eux, de façon indéniable, des filiations structurales. Ils sont obtenus à partir d’un processus de précipitation de sels de fer divalent, en milieu neutre ou légèrement basique et en milieu oxydant.
Les composés de structure tridimensionnelle
Wustite, ferrihydrite, goethite, hématite, maghémite, magnétite, akaganéite
Wustite
L’oxydation du fer en l’absence de dioxyde de carbone (pour éviter la formation de carbonate), par de l’air humide conduit d’abord à la formation de l’oxyde de fer divalent FeO appelé wustite d’après le nom de Ewald Wüst (1875-1934), géologue et paléontologue allemand. L’hydroxyde ferreux Fe(OH)2 n’est obtenu qu’en milieu aqueux à pH élevé.
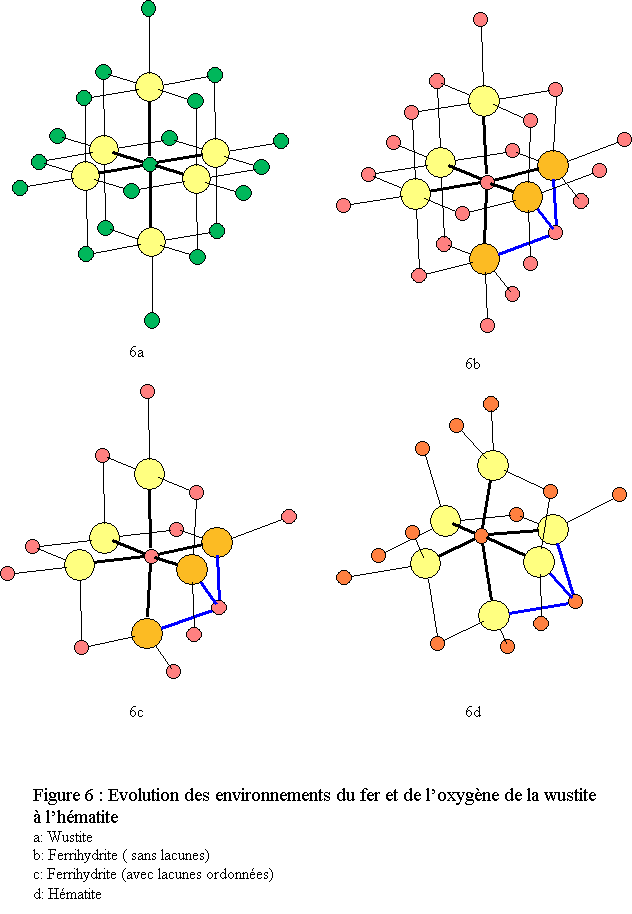
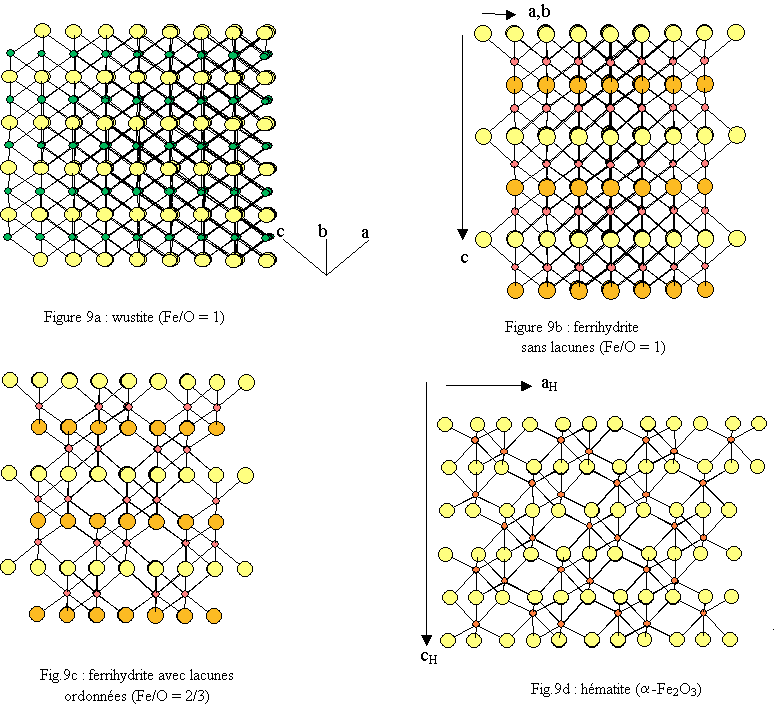
La wustite est instable en présence d’oxygène car le fer divalent s’oxyde en fer trivalent si bien que la wustite est en réalité un composé mixte contenant une partie de Fe3+ ce qui génère des lacunes cationiques : Fe1-x O. La wustite a une structure cubique de type NaCl, de groupe d'espace Fm3m (n°225) avec
- a = 4,30 Å.
Elle est constituée de deux réseaux (Fe et O) imbriqués, cubiques faces centrées (cfc)[10]. Les environnements du fer et de l’oxygène sont octaédriques : FeO6 et OFe6 (voir figures 6a et 7a).
en:Ferrihydrites
Lorsque l’oxydation du fer en présence d’air humide est complète il se forme un composé très mal cristallisé caractérisé par un diagramme X de poudre présentant plus ou moins de raies de diffraction selon l’état de cristallisation : 2-line ou 6-line ferrihydrite. Les analyses chimiques aboutissent à la formule brute suivante :
- 5 Fe2O3, 9 H2O
correspondant à un oxyde hydraté avec une faible substitution des oxygènes par des groupements OH :
- Fe5(OH)O7, 4H2O.
La structure cristalline de la 6-line ferrihydrite peut être décrite comme la juxtaposition désordonnée de deux sous-ensembles structuraux[11].
- Une phase trigonale de groupe d'espace P-31c (n°163), construite à partir de couches compactes d’anions O2- et OH- empilées selon le paramètre c dans l’ordre suivant : ABACA (fig. 7b). Les paramètres cristallins donnés dans une maille hexagonale ont pour valeur :
- a = 2,955 Å,
- c = 9,37 Å.
- Une phase qui correspond à une sous-structure de la précédente, plus désordonnée, de groupe P3 (N°143) et de paramètres
- a = 2,955 Å.,
- c = 9,37/2 = 4,685 Å.
- Elle est constituée de couches d’anions de séquences ABA ou ACA.
La structure est caractérisée par la présence de nombreuses lacunes de fer réparties de façon désordonnée dans la 2-line ferrihydrite et qui s’organisent progressivement avec la cristallisation vers la formation de la 6-line ferrihydrite.
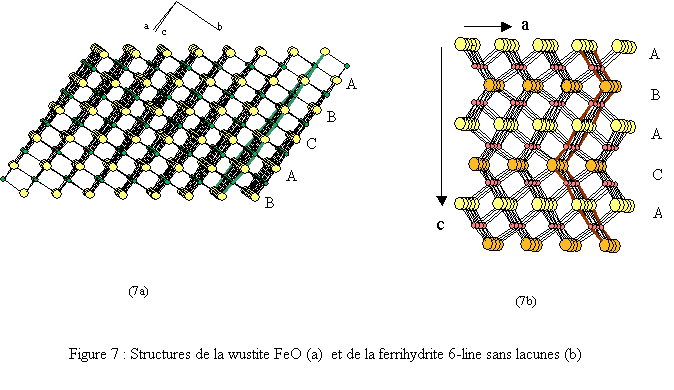
La structure de la 6-line ferrihydrite présente une ressemblance avec la wustite FeO (fig. 7) mais aussi avec l’hématite α-Fe2O3.
Remarques: Une étude récente portant sur la structure de la ferrihydrite, propose une autre maille cristalline. Elle a été établie par une méthode nouvelle de détermination structurale plus appropriée aux composés très mal cristallisés ( Pair Distribution Function )[12]. La ferrihydrite serait isotype d'un composé analogue d'aluminium l'en:Akdalaite, de formule Al10O14(OH)2. Cette étude est néanmoins contredite par une publication plus récente[13]. La structure de la ferrihydrite est toujours l'objet de controverse.
Hématite
L’hématite α-Fe2O3 est l’oxyde de fer le plus stable d’un point de vue thermodynamique. Il n’est pas étonnant de le trouver en abondance dans la nature. Sa couleur rouge à l’état pulvérulent, est à l’origine de son nom (du grec haima : sang) mais les cristaux ont une couleur gris métallique sombre.
La structure de l’hématite a été déterminée par Pauling et coll. en 1925[14] et revisitée par Blake et coll. en 1970[15]. Elle est isotype du corindon α-Al2O3. La symétrie est rhomboédrique de groupe d'espace R-3c (n° 167). Les paramètres de maille donnés dans une maille hexagonale sont les suivants :
- a = 5,0346 Å,
- c = 13,752 Å.
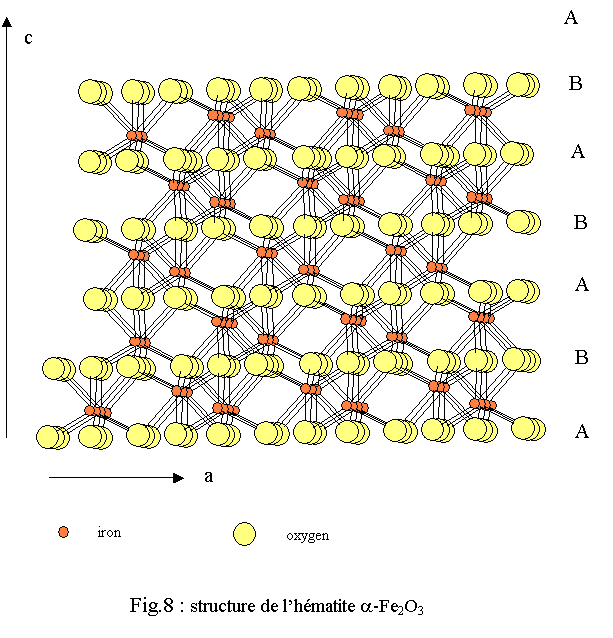
La structure tridimensionnelle est construite avec des polyèdres de fer correspondant à des octaèdres FeO6 très déformés (déformation bi-pyramidale). Chaque polyèdre de fer trivalent est relié à 13 autres polyèdres par une face, trois arêtes et six sommets ; l’oxygène étant dans un environnement tétraédrique de fer OFe4[16]. L’empilement compact des oxygènes est du type hc (ABA) très légèrement déformé (voir fig.8 ).La similitude des structures de la ferrihydrite avec celles de la wustite et de l’hématite apparaît clairement lors de la comparaison des environnements du fer et de leurs évolutions lorsque l’on passe de la wustite à l’hématite via la ferrihydrite (figure 6). Cette similitude apparaît également lorsque l’on compare les enchaînements des polyèdres (figure 9). Une hypothèse de filiations structurales entre ces trois phases solides a été développée dans une récente publication[17].
Goethite
La précipitation de solutions de sels ferriques en milieu acide ou basique aboutit généralement à la formation d’un oxy-hydroxyde de formule α-FeO(OH) appelé goethite en l’honneur du célèbre poète allemand Johann Wolfgang von Goethe (1749–1832). La goethite cristallise dans une maille orthorhombique de groupe d'espace Pnma (n° 62). Les paramètres de la maille ont pour valeurs :
- a = 9,95 Å,
- b = 3,01 Å,
- c = 4,62 Å.
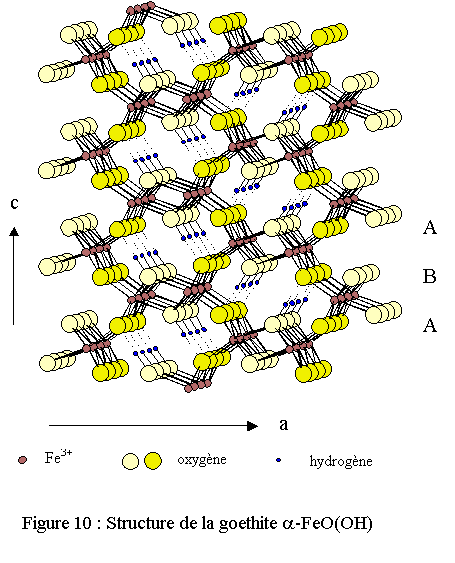
La structure tridimensionnelle est construite à partir d’octaèdres FeO3(OH)3 formant des tunnels qui s’étendent suivant la direction [010] et où sont placés les atomes d’hydrogène (voir fig. 10). Chaque octaèdre de fer est relié à huit octaèdres voisins par 4 arêtes et 4 sommets ; les atomes d’oxygène se trouvant dans un environnement tétraédrique OFe3H ou OFe3-H (liaison H forte). Les atomes d'oxygène définissent des couches de type hexagonal compact hc (ABA) comme dans l’hématite ; les deux structures présentant une indéniable filiation structurale. En effet, la goethite se transforme facilement en hématite par thermolyse à 540 K[18]. Dans la nature, elle se présente sous la forme de cristaux brun-noirs devenant brun-jaunes après broyage.Magnétite, maghémite
La thermolyse de la lépidocrocite γ-FeO(OH) ne donne jamais directement naissance à l’hématite α-Fe2O3, qui est pourtant le composé le plus stable et constitue la phase terminale de l’oxydation du fer. Un composé intermédiaire se forme appelé maghémite (contraction de magnétite et de hématite), de formule γ-Fe2O3. Il possède en effet, une structure similaire à celle de la magnétite de formule Fe3O4.
La magnétite est un oxyde mixte de fer(II) et de fer(III) de structure spinelle ( aluminate de magnésium: Mg(II)[ Al(III)2O4] ) ; le cation divalent Mg(II) se trouvant en sites tétraédriques et le cation trivalent Al(III) en sites octaédriques. Dans le cas de la magnétite Fe(III)[Fe(III)Fe(II)O4], le spinelle est inverse car les sites tétraédriques sont occupés par un cation trivalent. Pour ce qui concerne la maghémite, le fer se trouve entièrement dans l’état trivalent d’oxydation ce qui se traduit par l’apparition de lacunes cationiques, notées □.
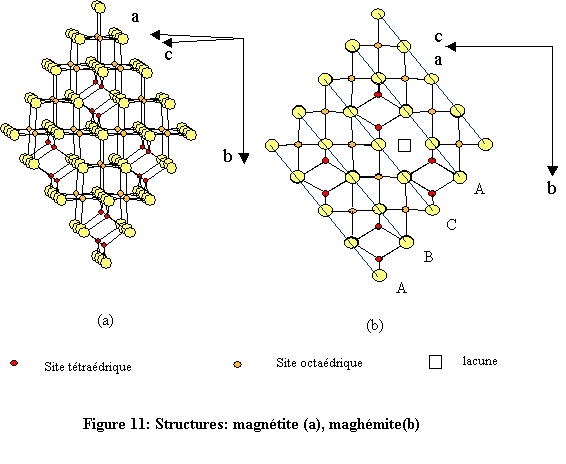
La formule de la maghémite en relation avec celle de la magnétite peut s’écrire :- Fe(III)tétra[(Fe(III)5/3 □1/3)octaO4].
La maghémite peut être considérée comme une magnétite oxydée. Les structures de la magnétite et de la maghémite présentent évidemment une grande similitude même si leur groupes spatiaux sont différents.
La magnétite cristallise dans le système cubique, groupe d'espace Fd-3m (n° 227),- a = 8,396 Å.
La présence de lacunes cationiques ordonnées dans la maghémite se traduit par la cristallisation dans le système quadratique de groupe P41212 (n° 92) et de paramètres
- a = 8,35 Å,
- c = 3·a = 25,05 Å.
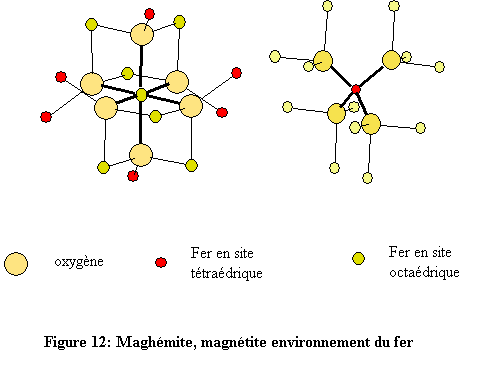
Les deux structures sont construites à l’aide d’octaèdres FeO6 et de tétraèdres FeO4 (Fig. 11). Chaque octaèdre est relié à six autres octaèdres par six côtés et à six différents tétraèdres par six sommets. Quant à l’environnement tétraédrique du fer, chaque tétraèdre est relié à douze octaèdres par ses quatre sommets (fig. 12). L’environnement de l’oxygène est constitué de quatre atomes de fer, trois en sites octaédriques et un en site tétraédrique. Les atomes d’oxygène définissent des couches à empilement compact de type cubique à faces centrées (cfc : ABC )[19]. À l’état naturel, la magnétite se présente sous la forme de cristaux gris foncé d’éclat métallique.
en:Feroxyhyte, en:Akaganéite
Il existe deux autres composés du fer qui appartiennent à cette famille d’oxydes et hydroxydes. Il s’agit de la feroxyhyte δ-FeO(OH), variété de haute pression (on la trouve au fond des océans profonds). Elle est mal connue, notamment sa structure cristalline. Le deuxième composé n’est pas strictement un oxy-hydroxyde de fer car, comme les rouilles vertes, il contient des anions en insertion, notamment le chlorure. Il s’agit de l’akaganéite de formule:
- ß-Fe O1-x (OH)1+x Clx.
Elle tire son nom de la mine d’Akagane au Japon. La maille donnée dans le groupe conventionnel C2/m (N° 12) est monoclinique[20] :
- a = 14,896 Å,
- b = 3,0339 Å,
- c = 10,600 Å,
- ß = 135,13°.
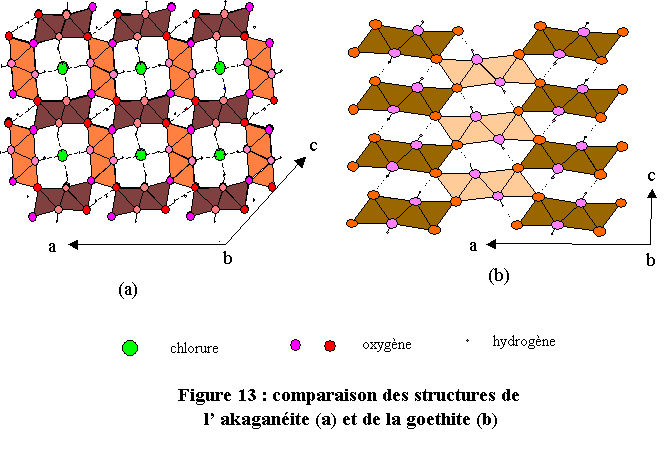
L’akaganéite présente une ressemblance évidente avec la goethite. Les deux structures sont tridimensionnelles et constituées d’octaèdres FeO6, accolés par paires qui définissent des tunnels se développant suivant le paramètre b. Dans le cas de la goethite six octaèdres définissent le tunnel alors que dans l’akaganéite il y en a huit. L’akaganéite développe donc des tunnels beaucoup plus grands que dans la goethite. Ils peuvent ainsi accueillir des ions chlorure Cl-, indispensables pour la cohésion de la structure (voir la figure 13 sur laquelle on a fait figurer les liaisons hydrogène). L’akaganéite joue un rôle dans la corrosion en milieu marin.Conclusions
L’exposé précédent a fait le tour des structures cristallines des différents hydroxydes, oxy-hydroxydes ou oxydes de fer en essayant de dégager les similitudes et les relations qui peuvent exister entre ces structures dans le but de tenter de comprendre les processus de formation ou de transformations de ces composés.
La difficulté est immense car à l’état naturel il n’existe que très rarement des phases pures. De nombreux cations autres que le fer et de nombreux anions interfèrent sur les processus de formation en jouant le rôle de catalyseur ou un rôle d’inhibition des réactions. Il faut ajouter à cela, la présence de bactéries qui tirent l’énergie nécessaire à leur métabolisme, de la réduction du fer trivalent en fer divalent. Cela se traduit par un retour en arrière dans l’évolution naturelle du fer métallique en milieu oxydant, vers l’état trivalent d’oxydation; l’hématite étant l’oxyde de fer le plus stable et normalement le point final du processus d’oxydation.
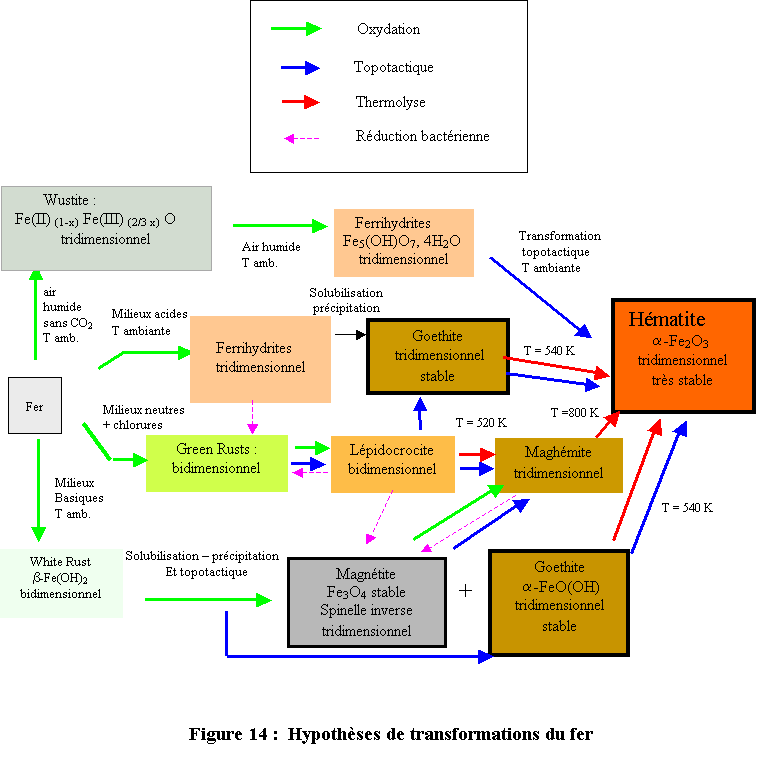
Il est donc très difficile de proposer des schémas exhaustifs permettant d’expliquer la formation de ces composés. Néanmoins quelques hypothèses de transformations basées sur des filiations structurales qui rendent compte de façon plus ou moins satisfaisante de la réalité rencontrée sur le terrain, peuvent être proposées. Ces hypothèses sont rassemblées sur le schéma d’ensemble reporté à la figure 14.
Il semble qu’il existe quatre processus principaux d’oxydation du fer métallique pour aboutir au stade final hématite correspondant à la stabilité thermodynamique la plus élevée :
- Oxydation à l’air humide ( à l’abri de CO2),
- Oxydation en milieux aqueux acides,
- Oxydation en milieux aqueux neutres en présence d’anions notamment chlorure,
- Oxydation en milieux basiques.
Ces différentes routes aboutissent à des phases intermédiaires plus ou moins métastables. L’extrême faiblesse de la solubilité de toutes ces phases solides n’exclut pas les transformations de reconstruction par dissolution et cristallisation dans la mesure où il existe une différence de solubilité aussi faible soit-elle mais en revanche, elle permet certainement le développement de réactions dans l’état solide lorsqu’il existe des filiations structurales entre les structures de ces composés. Ce type de transformation appelée Transformation topotactique est parfois le seul argument permettant d’expliquer pourquoi un précurseur donne naissance à une phase particulière plutôt qu’à une autre. Le processus de transformations topotactiques partant de la GR1(Cl) pour donner la (en)maghémite via la lépidocrocite en est un bon exemple.
Annexes
Bibliographie
- Y.Cudennec, A. Lecerf, C.R.Acad.Sci.Paris, Chimie 4 (2001) 885-891.
- J.B.Parise, W.G.Marshall, R.I.Smith, H.D.Lutz, H.Möller, Amer. Mineral., 85 (2000) 189-193.
- J.M.R. Génin, C. Ruby, Solid State Sciences, 6 (2004) 705-718.
- Y.Cudennec, A.Lecerf, C.R.Chimie 6 (2003) 437-444 [(en) lire en ligne].
- A.P. Zhukhlistov, Crystallogr. Rep. 46 (5) (2001) 730–733.
- R.M. Cornell, U. Schwertmann, 1996, The iron oxides structure, properties, reactions, occurrences and uses, V.C.H., Weinheim.
- E. Jansen, A. Kyek, W. Schäfer, U. Schwertmann, Appl. Phys. A74 (2002) pp.1004-1006.
- L. Pauling, S.B. Hendricks, J. Amer. Chem. Soc. 47 (1925) 781–790.
- R.L. Blake, T. Zoltai, R.E. Hessevick, L.W. Finger, U.S. Dept. of Interior, Bureau of Mines, 1970, pp. 1–20.
- Y. Cudennec, A. Lecerf, Solid State Sciences, 7 (2005), pp.520-529 [(en) lire en ligne].
- Y. Cudennec, A. Lecerf, J.Solid State Chem., 179(3) (2006), pp.716-722 [(en) lire en ligne].
- J.E. Post and V.F. Buchwald, Amer. Mineralogist, 76 (1991) pp.272-277.
- Trolard F., Abdelmoula M., Bourrié G., Humbert B., Génin J.-M. R. (1996) Mise en évidence d'un constituant de type «rouilles vertes» dans les sols hydromorphes. Proposition de l'existence d'un nouveau minéral : la «fougérite». Comptes rendus de l'Académie des sciences. Série 2. Sciences de la terre et des planètes, ISSN 1251-8050, vol. 323, no12, pp. 1015-1022.
- Trolard, F.; Génin, J.-M. R.; Abdelmoula, M.; Bourrié, G.; Humbert, B.; Herbillon, A. (1997) Identification of a green rust mineral in a reductomorphic soil by Mossbauer and Raman spectroscopies, Geochimica et Cosmochimica Acta, v. 61, p. 1107-1111.
- Feder, F.; Trolard, F.; Klingelhofer, G.; Bourrie, G. (2005) In situ Mossbauer spectroscopy: Evidence for green rust (fougerite) in a gleysol and its mineralogical transformations with time and depth. Geochimica et Cosmochimica Acta, v. 69, iss. 18, p. 4463-4483.
Références
- ↑ Y.Cudennec, A. Lecerf, C.R.Acad.Sci.Paris, Chimie 4 (2001) 885-891.
- ↑ J.B.Parise, W.G.Marshall, R.I.Smith, H.D.Lutz, H.Möller, Amer. Mineral., 85 (2000) 189-193.
- ↑ Trolard F., Abdelmoula M., Bourrié G., Humbert B., Génin J.-M. R. (1996) Mise en évidence d'un constituant de type «rouilles vertes» dans les sols hydromorphes. Proposition de l'existence d'un nouveau minéral : la «fougérite». Comptes rendus de l'Académie des sciences. Série 2. Sciences de la terre et des planètes, ISSN 1251-8050, vol. 323, no12, pp. 1015-1022.
- ↑ Trolard, F.; Génin, J.-M. R.; Abdelmoula, M.; Bourrié, G.; Humbert, B.; Herbillon, A. (1997) Identification of a green rust mineral in a reductomorphic soil by Mossbauer and Raman spectroscopies, Geochimica et Cosmochimica Acta, v. 61, p. 1107-1111.
- ↑ Feder, F.; Trolard, F.; Klingelhofer, G.; Bourrie, G. (2005) In situ Mossbauer spectroscopy: Evidence for green rust (fougerite) in a gleysol and its mineralogical transformations with time and depth. Geochimica et Cosmochimica Acta, v. 69, iss. 18, p. 4463-4483.
- ↑ Trolard F., Abdelmoula M., Bourrié G., Humbert B., Génin J.-M. R. (1996) Mise en évidence d'un constituant de type «rouilles vertes» dans les sols hydromorphes. Proposition de l'existence d'un nouveau minéral : la «fougérite». Comptes rendus de l'Académie des sciences. Série 2. Sciences de la terre et des planètes, ISSN 1251-8050, vol. 323, no12, pp. 1015-1022.
- ↑ Trolard, F.; Génin, J.-M. R.; Abdelmoula, M.; Bourrié, G.; Humbert, B.; Herbillon, A. (1997) Identification of a green rust mineral in a reductomorphic soil by Mossbauer and Raman spectroscopies, Geochimica et Cosmochimica Acta, v. 61, p. 1107-1111.
- ↑ Y.Cudennec, A.Lecerf, C.R.Chimie 6 (2003) 437-444 [(en) lire en ligne].
- ↑ A.P. Zhukhlistov, Crystallogr. Rep. 46 (5) (2001) 730–733.
- ↑ R.M. Cornell, U. Schwertmann, 1996, The iron oxides structure, properties, reactions, occurrences and uses, V.C.H., Weinheim.
- ↑ E. Jansen, A. Kyek, W. Schäfer, U. Schwertmann, Appl. Phys. A74 (2002) pp.1004-1006.
- ↑ Marc Michel, Lars Ehm, Sytle M. Antao, Peter L. Lee, Peter J. Chupas, Gang Liu, Daniel R. Strongin, Martin A. A. Schoonen, Brian L. Phillips, John B. Parise, Science 316(5832) (2007) pp.1726-1729.[(en) lire en ligne]
- ↑ D.G. Rancourt* and J.-F. Meunier, American Mineralogist, Volume 93(2008) pages 1412–1417.[(en) lire en ligne]
- ↑ L. Pauling, S.B. Hendricks, J. Amer. Chem. Soc. 47 (1925) 781–790.
- ↑ R.L. Blake, T. Zoltai, R.E. Hessevick, L.W. Finger, U.S. Dept. of Interior, Bureau of Mines, 1970, pp. 1–20.
- ↑ Y. Cudennec, A. Lecerf, Solid State Sciences, 7 (2005), pp.520-529 [(en) lire en ligne].
- ↑ Y. Cudennec, A. Lecerf, J.Solid State Chem., 179(3) (2006), pp.716-722 [(en) lire en ligne].
- ↑ Y. Cudennec, A. Lecerf, Solid State Sciences, 7 (2005), pp.520-529 [(en) lire en ligne].
- ↑ Y. Cudennec, A. Lecerf, Solid State Sciences, 7 (2005), pp.520-529 [(en) lire en ligne].
- ↑ J.E. Post and V.F. Buchwald, Amer. Mineralogist, 76 (1991) pp.272-277.
Articles connexes
Liens externes
- http://www.mindat.org/mineralindex.php
- http://rruff.geo.arizona.edu/AMS/amcsd.php
- Simulation par voie chimique des processus de corrosion en milieux aqueux, Université de La Rochelle
- Portail de la chimie
- Portail des sciences de la Terre et de l’Univers
Catégories : Minéralogie | Oxyde | Hydroxyde | Composé du fer | Cristallographie
Wikimedia Foundation. 2010.
