- Oxyde de fer
-
 Poudre d'hématite α-Fe2O3.
Poudre d'hématite α-Fe2O3.
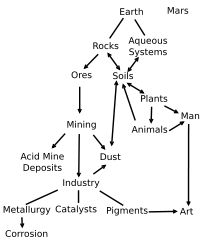
Un oxyde de fer est un composé chimique résultant de la combinaison d'oxygène et de fer.
Sommaire
Typologie
Il en existe trois, différant par l'état d'oxydation de leurs atomes de fer :
- oxyde de fer(II) FeO, également appelé oxyde ferreux, et wustite sous sa forme minérale, poudre noire inflammable utilisée parfois dans la conception d'explosifs,
- oxyde de fer(II,III) Fe3O4 ou FeO∙Fe2O3, parfois appelé oxyde magnétique, et magnétite sous sa forme minérale,
- oxyde de fer(III) Fe2O3, également appelée oxyde ferrique, et se présentant sous quatre phases :
- α-Fe2O3 ou hématite, de couleur grise lorsqu'elle est cristallisée, mais rouge à l'état pulvérulent ou amorphe, couleur caractéristique de la rouille ainsi que de la planète Mars
- β-Fe2O3,
- γ-Fe2O3 ou maghémite,
- ε-Fe2O3.
Usages
Les oxydes de fer donnent aux sols leurs couleurs et permettent d'en déterminer leur degré de drainage (sol jaune brun "rouillé" en profondeur pour les sols bien drainés et sols grisâtres dans les mal drainés).
Les Égyptiens utilisaient des oxydes de fer pour créer la couleur rouge quand ils gravaient des hiéroglyphes.
Utilisation en imagerie médicale
L'imagerie médicale de résonance magnétique nucléaire utilise comme produit de contraste des oxydes de fer, sous deux formes
- Forme microparticulaires, dite small superparamagnetic iron oxide ou SPIO, de plus de 50 nanomètres.
Les particules sont injectées dans les veines, pour détecter les lésions hépatiques de petite taille et accessoirement pour les caractériser.
Une ingestion par la bouche permet aussi de
diagnostiquer certains problèmes du tube digestif ;
- Forme nanoparticulaire, dite ultrasmall superparamagnetic iron oxide ou USPIO).
Après administration intraveineuse, étant moins capturés par le foie et la rate, ils ont une demi-vie plasmatique assez longue (plus de 36 heures). Les macrophages normalement présents dans les tissus (ganglions lymphatiques) ou en cas de pathologie (sclérose en plaque, rejet de greffe, plaque d’athérome, accident vasculaire cérébral, arthrite rhumatoïde…) peuvent les assimiler.
Ils sont utilisés pour détecter des cancers, des maladies dégénératives et inflammatoires mais aussi pour les pathologies cardiovasculaires comme les plaques d'athéromes. Ce sont aussi des biomarqueurs permettant de mesurer l'effet de certains traitements[1].
Ces oxydes sont, sous ces deux tailles différentes, souvent formulées avec du dextran ou ses dérivés[2].
En dépit de risques suspectés pour la santé, les nanoparticules d'oxyde de fer sont approuvées par la FDA pour cet usage au regard du bénéfice qu'il apporte pour le diagnostic de certaines pathologies, grâce au champ magnétique local qu’ils génèrent (« effet superparamagnétique »)[3]). Les oxydes métalliques nanoparticulaires semblent très intéresants comme produits de contraste (testés chez l'animal pour d'autres métaux), mais des « défis majeurs restent à relever en matière de sécurité et de questions de métabolisme »[4],[5].Usages en tant que pigments
Les oxydes de fer sont utilisés depuis l'Antiquité en tant que pigments.
On trouve parmi les oxydes de fer naturels :
- L'ocre jaune (PY43) qui va du jaune verdâtre au jaune orangé
- L' ocre rouge (PR102) aux différentes nuances brun-rouge
- La terre de Sienne (PBr7), naturelle (jaunâtre) ou brûlée (rougeâtre)
- La terre d'ombre (PBr7), naturelle (jaunâtre) ou brûlée (rougeâtre)
Les ocres sont des terres argileuses colorées par de l'oxyde de fer. Elles se distinguent des terres (Sienne et ombre) par leur proportion plus faible en oxyde de fer (moins de 25%).
La terre d'ombre, d'un brun soutenu, se distingue de la terre de Sienne par sa forte proportion en oxydes de manganèse.
Une terre brûlée est une terre naturelle calcinée. Sa teinte plus ou moins rougeâtre dépendra de son degré de calcination.
Depuis le début du XXe siècle, les oxydes de fer naturels tendent à disparaitre au profit des oxydes de fer synthétiques. On trouve ces derniers sous le nom de couleurs de Mars : jaune (PY42), rouge (PR101), noir (PBk11).
Alimentation
L'oxyde de fer est aussi utilisé comme colorant alimentaire (E172)[6]
Voir aussi
Articles connexes
Liens externes
- (fr)
Bibliographie
Références
- B. Bonnemain , Mise au point Nanoparticules : le point de vue d’un industriel. Applications en imagerie diagnostique ; Nanoparticles: The industrial viewpoint. Applications in diagnostic imaging ; Annales Pharmaceutiques Françaises Volume 66, Issues 5-6, November-December 2008, Pages 263-267 doi:10.1016/j.pharma.2008.07.010 (Résumé)
- Oleg Lunov, Tatiana Syrovets, Berthold Büchele, Xiue Jiang, Carlheinz Röcker, Kyrylo Tron, G. Ulrich Nienhaus, Paul Walther, Volker Mailänder, Katharina Landfester, Thomas Simmet, The effect of carboxydextran-coated superparamagnetic iron oxide nanoparticles on c-Jun N-terminal kinase-mediated apoptosis in human macrophages ; Biomaterials, Volume 31, Issue 19, July 2010, Pages 5063-5071
- Jesse L. Winer, Charles Y. Liu, Michael L.J. Apuzzo, The Use of Nanoparticles as Contrast Media in Neuroimaging: A Statement on Toxicity ; World Neurosurgery, Available online 7 November 2011, doi:10.1016/j.wneu.2011.08.013 (Résumé)
- Tore Skotland, Tore-Geir Iversen, Kirsten Sandvig, New metal-based nanoparticles for intravenous use: requirements for clinical success with focus on medical imaging (Review Article) Nanomedicine: Nanotechnology, Biology and Medicine, Volume 6, Issue 6, December 2010, Pages 730-737 (Résumé)
- Claire Corot, Philippe Robert, Jean-Marc Idée, Marc Port, Recent advances in iron oxide nanocrystal technology for medical imaging (Review Article), Advanced Drug Delivery Reviews, Volume 58, Issue 14, 2006-12-01, Pages 1471-1504 (Résumé)
- Codex alimentarius, « Noms de catégorie et système international de numérotation des additifs alimentaires » sur http://www.codexalimentarius.net, 2009. Consulté le 19 mai 2010
Catégories :- Oxyde
- Composé du fer
- Colorant alimentaire
- Pigment
- Pigment naturel
- Pigment minéral
- Pigment synthétique
Wikimedia Foundation. 2010.