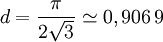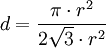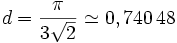- Hexagonal compact
-
Empilement compact
L'empilement compact est la manière d'agencer des sphères dans l'espace afin d'avoir la plus grande densité de sphères, sans que celles-ci ne se recouvrent.
C'est un problème que l'on se pose en général en géométrie euclidienne dans l'espace à trois dimensions, mais on peut aussi le généraliser au plan euclidien (les « sphères » étant alors des cercles), dans un espace euclidien à n dimensions (n > 3), avec des hypersphères, ou dans un espace non-euclidien.
Sommaire
Arrangement compact de cercles dans un plan
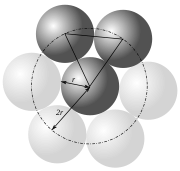
Sur un plan, on peut disposer au maximum six cercles de rayon r autour d'un cercle de même rayon. Les centres de trois cercles en contact, définissent un triangle équilatéral puisqu'ils sont distants de 2r les uns des autres. Chaque angle valant 60° (π/3), on peut mettre ainsi 6 triangles avec un sommet en commun pour former un hexagone régulier.
On peut constater aisément que c'est l'organisation la plus compacte qui soit en rangeant des billes de même volume dans une enceinte de taille appropriée.
Carl Friedrich Gauss prouva qu'aucun arrangement régulier n'est plus dense. Tel n'est pas le cas lorsque les sphères n'ont pas la même taille (voir l'arrangement de rondelles d'agrumes).
La densité surfacique de cet arrangement est
- Calcul
- Considérons quatre cercles en contact deux à deux. Les centres de ces cercles forment un losange de côté 2r. On peut ainsi découper le plan en un pavage de losanges définissant un réseau.
- Chaque losange comprend deux portions de disques de 2π/3 et deux portions de disques de π/3. La somme des aires de ces portions de disques est donc égale à la surface d'un disque, soit πr2.
- Le losange lui-même a pour aire 2√3·r². Les disques occupent donc une proportion de surface égale à
Empilement compact de sphères
 empilement compact de 35 sphères
empilement compact de 35 sphères
Considérons trois sphères en contact sur un plan (plan A). On peut placer une quatrième sphère posée sur le creux entre les trois premières, les centres des sphères formant un tétraèdre régulier.
En positionnant ainsi des sphères dans les creux du plan compact A, on obtient un deuxième plan compact (plan B). Gauss montra que cette organisation était l'organisation régulière ayant la plus grande densité. En 1611, Johannes Kepler conjectura que c'était l'arrangement spatial le plus compact. Cette conjecture n'a toujours pas été prouvée, mais selon les travaux de Thomas Hales et Andrew Mellon à l'Université de Pittsburgh en 1998, cette conjecture est une quasi certitude.
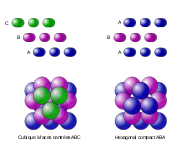
Lorsque l'on ajoute un troisième plan, on peut mettre les sphères soit en correspondance avec celles du premier plan (plan A), soit dans une troisième possibilité de placement définissant un nouveau plan compact (plan C).
Il existe ainsi trois types de plans compacts A, B et C qui peuvent en se combinant engendrer une infinité de types d'empilements compacts :
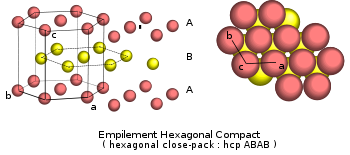
- A-B-A-B… empilement dit « hexagonal compact »
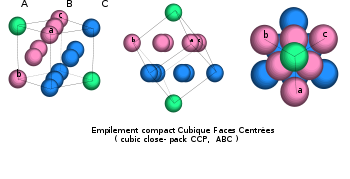
- A-B-C-A-B-C… empilement dit « cubique à faces centrées »
- A-B-A-C-A-B-A-C…
- A-B-C-B-A-B-C-B…
- …
Quel que soit l'arrangement, chaque sphère est entourée de 12 autres sphères, et la densité volumique vaut dans tous les cas:
- Calcul
- Le calcul peut se faire de manière simple sur un empilement cubique à faces centrées et sur un empilement hexagonal compact (voir le lien externe pour le calcul). Pour les autres empilements compacts, il suffit de découper la structure en groupes de trois plans pour se retrouver dans l'un des cas précités.
Application en cristallographie
En cristallographie, les atomes ou les ions peuvent s’organiser en couches compactes. C'est notamment le cas pour les structure métalliques, les cristaux n'étant formés que d'un seul type de particules. Si on les modélise par des sphères, l’empilement est compact lorsque les sphères sont en contact.
Les deux principaux types d'empilement compact sont :
- Hexagonal compact hc (ou hcp pour Hexagonal close-packed) ; les couches d’atomes s’empilant suivant l’ordre ABAB.
- Cubique à faces centrées cfc (ou ccp pour cubic close-packed) ; les couches d’atomes s’empilant suivant l’ordre ABC.
Voir l’exemple des oxydes et hydroxydes de fer :
- Structures cristallines des hydroxydes oxy-hydroxydes et oxydes de fer
- cfc : l'austénite, l'aluminium
La densité volumique porte le nom de compacité. Le taux de remplissage est d'environ 74% (26% de vide).
Voir aussi
Articles connexes
Liens externes
- Éléments de cristallographie : empilement compact
- calcul compacité
- Exploration de la construction d'empilements compacts
- Portail de la géométrie
Catégories : Géométrie discrète | Cristallographie | Minéralogie
Wikimedia Foundation. 2010.