- Acide éthanedioïque
-
Acide oxalique
Acide oxalique 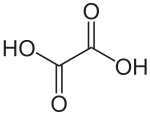
Structure de l'acide oxalique Général Nom IUPAC Acide éthanedioïque Synonymes sel d'oseille No CAS (anhydre)
(dihydrate)No EINECS SMILES InChI Apparence cristaux incolores inodores [1] Propriétés chimiques Formule brute C2H2O4 [Isomères] Masse molaire 90,0349 g∙mol-1
C 26,68 %, H 2,24 %, O 71,08 %,
126,07 (dihydrate)pKa pKA1 = 1,2 (à 25 °C)
pKA2 = 4,3 (à 25 °C)Propriétés physiques T° fusion 189,5 °C (α) [2],[3]
180,5 °C (dihydrate) [3]T° ébullition >160 °C (décomposition en acide formique, CO, CO2, H2O) [4] Solubilité 220 g/L (eau, 25 °C) [2][1],
dans l'eau : 10 g/100 ml (dihydrate)[5]Masse volumique 1,9 g/cm³ (20 °C) [1]
1,653 g/cm³ (dihydrate)[4]Point d’éclair 166 °C Thermochimie ΔfH0solide -829 kJ/mol Cp 106 J/mol·K Précautions Directive 67/548/EEC 
XnPhrases R : 21/22, Phrases S : 2, 24/25, [6] Transport 80/88 3261 [1]NFPA 704 SIMDUT[7],[8] Acide oxalique :


Acide oxalique dihydraté :

SGH[9] 
AttentionInhalation Les vapeurs peuvent être mortelles. Peau Peut provoquer de graves blessures. Yeux Très dangereux, brûlures profondes. Ingestion Ingestion toxique, voire mortelle Autre Émission de fumées toxiques en brûlant. [4] Écotoxicologie DL50 375 mg/kg (rat, oral)[10]
270mg/kg (souris, i.p.) [2]LogP -0.7 (estimé)[11] Unités du SI & CNTP, sauf indication contraire. L'acide oxalique de structure HOOC-COOH, l'acide éthanedioïque d'après la nomenclature officielle est le plus simple des acides dicarboxyliques aliphatiques. Le produit commercial est un dihydrate, HOOC-COOH, 2 H2O
Grâce à la liaison entre les deux groupes carboxyles, il est l'un des acides organiques les plus forts (pKA1 = 1,27 et pKA2 = 4,27). Les anions de l'acide oxalique ainsi que les sels et esters sont connus sous le nom d'oxalates.
Sommaire
Origine et fabrication
On le trouve à l'état naturel sous forme d'oxalate de potassium ou de calcium dans les racines et rhizomes de nombreuses plantes telles que le rumex, la rhubarbe, la betterave, l'oseille et les plantes de la famille des oxalis. Ce dernier terme d'origine grecque signifie oseille. Le sel d'oseille est connu et d'emploi commun comme rongeant, décolorant en teinture, détartrant et complexant éliminant les tâches de rouille, vernis et encres depuis le 18e siècle.
Le composé chimique pur a été découvert en 1776 par le chimiste suédois Carl Wilhelm Scheele en procédant à l'oxydation du sucre par l'acide nitrique d'où son autre nom : l'acide de sucre. Friedrich Wöhler synthétise en 1824 ce produit naturel, et inaugure ainsi la synthèse chimique de produit naturel, détruisant la vigueur des doctrines vitalistes qui séparaient drastiquement autrefois le règne minéral du règne végétal ou animal. Les oxalates sont présents dans l'urine animale et humaine, ils forment aussi des composés minéraux dans les rognons de silex.
Fabrication industrielle
L'oxydation des glucides les plus communs, en particulier l'amidon, voire la sciure de bois, donne l'acide oxalique, qui était souvent transformée autrefois sous forme de sels de potassium, d'où le nom de sel d'oseille. Les différents procédés d'autrefois comporte la fusion alcaline de la cellulose. On pouvait aussi obtenir l'acide oxalique avec le monoxyde de carbone et la soude à 300 °C. Un autre procédé équivalent consiste à chauffer le formiate de sodium.
De façon industrielle (Rhône-Poulenc), l'acide oxalique est obtenu par deux oxydations successives, à l'aide d'acide nitrique puis de dioxygène de l'air en présence d'un catalyseur.
Production végétale
L'acide oxalique et les oxalates sont des substances toxiques que l'on trouve dans de nombreuses plantes. On trouve parmi les aliments ayant une forte teneur en acide oxalique le cacao, le chocolat, les noix et noisettes, les baies, la rhubarbe, les haricots, l'oseille et les épinards. Présent à l'état naturel, essentiellement sous forme d'oxalate de calcium ou de potassium dans les racines et rhizomes de plantes telles que l'oseille, la rhubarbe ou la betterave, il intervient dans la constitution de certains minéraux (rognon de silex).
Plante Acide oxalique
(mg/100g, masse sèche)Épinards 460 – 3200 [10] Rhubarbe 500 – 2400 [10] Blette 690 [10] Persil 190 [10] Betterave 340 [10] Feuilles de betterave >12 000 [10] Cacao 4500 [10] Thé 3700 [10] cladodes de platyopuntia 13 000 [12] Certaines espèces de Penicillium et Aspergillus convertissent le sucre en oxalate de calcium avec un rendement de 90% dans les conditions optimales[13].
Propriétés
L'acide oxalique est un solide cristallin, incolore et inodore. Le dihydrate translucide est soluble dans l'eau, soit 12,5 % en masse à 25 °C. Il présente une faible solubilité dans les solvants organiques. La forme anhydre est très soluble dans l'alcool, très peu dans l'ether, et insoluble dans le benzène et le chloroforme.
Chauffé en présence d'acide sulfurique vers 160 °C, il se décompose en eau, monoxyde de carbone et dioxyde de carbone. Les propriétés réductrices douce de l'acide oxalique justifie son emploi d'étalon en manganimétrie, dans le dosage par le permanganate de potassium, mais aussi une toxicité apréciable.
Les sels d'oxalate non alcalins sont insoluble dans l'eau. L'oxalate de calcium est la cause de calculs rénaux.
Propriétés physico-chimiques
Solubilité dans l'eau :
Température Solubilité
(g/100 g)0 °C 3,5 [10] 10 °C 5,5 [10] 17,5 °C 8,5 [10] 20 °C 9,5 [10] 30 °C 14,5 [10] 40 °C 22 [10] 50 °C 32 [10] 60 °C 46 [10] 80 °C 85 [10] 90 °C 120 [10] Analyse
- Qualitative : en chauffant de l'acide oxalique avec de la diphénylamine, il se forme une couleur bleue appelée bleu d’aniline. Limite de l'analyse : 5 µg [10].
- Quantitative : elle peut se faire en l'absence d'autres acides, notamment avec du chlorure de calcium. Il se forme alors un précipité d'oxalate de calcium.
Toxicité et biologie
L'acide oxalique provoque des irritations locales importantes : l'absorption aisée par les muqueuses et la peau provoque des troubles de la circulation sanguine et des dommages rénaux.
Ingestion
Cet acide peut irriter la voie œsophagienne ou gastrique lors de son ingestion et provoquer des dommages rénaux (calculs, oligurie, albuminurie, hématurie). Il est mortel à forte dose, les précipités d'oxalate de calcium pouvant obstruer les canaux rénaux. Il apparaît dans l'urine animale et humaine sous forme d'oxalate de calcium et d'acide oxalurique (H2N-CO-NH-CO-CO2H). Les individus en bonne santé peuvent sans problème manger des aliments contenant de l'acide oxalique ou des oxalates, mais on recommande aux personnes atteintes de calcul rénaux, de goutte ou d'arthrite d'éviter leur consommation.
L'ingestion de calcium ou de magnésium freine le passage de l'acide oxalique dans le sang au niveau du tube digestif[4].
Effet biologique
À cause de sa capacité à se lier à certains minéraux tels que le calcium, le fer, le sodium, le potassium ou le magnésium, la consommation d'aliments à forte dose en acide oxalique peut provoquer des carences alimentaires.
Utilisations et applications
Agent de blanchiment des textiles , du cuir et du bois, mais aussi agent mordant pour les teintures, l'acide oxalique est aussi un produit industriel, dont la production annuelle mondiale est estimée à 140 000 tonnes par an en 2000.
Vendu en cristaux (sous le nom de sel de citron parfois) à dissoudre dans de l'eau, il est très efficace pour enlever la rouille et les traces de rouille sur le carrelage, le linge... Il semble également intéressant pour supprimer les taches de transpiration sur linge blanc en tamponnant.
L'acide oxalique est utilisé dans les domaines suivants :
- traitement de surface des métaux
- dérouillage et polissage du marbre
- agent de blanchiment (textile, papier, liège, cuir, bois)
- agent mordant pour la teinture de la laine
- initiateur dans la fabrication de polymères
- monomère pour la préparation de fibres et films plastiques - poly(éthylène oxalate) - présentant une résistance mécanique et un bon comportement à la chaleur.
- permet l'extraction de terres rares (lanthanides)
- préparation de supports magnétiques des bandes pour enregistrement.
- réducteur dans certains procédés de développement photographique.
- en apiculture, il sert à lutter contre le varroa.
Rôle secondaire dans la vinification
L’acide oxalique est présent dans le vin sous la forme de complexe ferrique d'oxalate. Quand le vin est mis en bouteilles, la réduction du fer ferrique libère de l'oxalate qui précipite sous forme d’oxalate de calcium.
Notes et références
- ↑ a , b , c et d Entrée de « Oxalic acid » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 16 février 2009 (JavaScript nécessaire)
- ↑ a , b et c (en) « Oxalic acid » sur ChemIDplus, consulté le 16 février 2009
- ↑ a , b et c (en) Hiroyuki Sawada et Toru Murakami, Kirk-Othmer encyclopedia of chemical technology 4th ed. : Oxalic acid, vol. 17, John Wiley & Sons., 1991
- ↑ a , b , c et d Fiche INRS
- ↑ ACIDE OXALIQUE DIHYDRATE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ ESIS. Consulté le 6 décembre 2008
- ↑ « Acide oxalique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ « Acide oxalique dihydraté » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ a , b , c , d , e , f , g , h , i , j , k , l , m , n , o , p , q , r , s et t (en) Wilhelm Riemenschneider et Minoru Tanifuji, Ullmann's Encyclopedia of Industrial Chemistry, Release 2004, 7th Edition, Oxalic Acid, Wiley-VCH Verlag GmbH & Co, 2000
- ↑ ACIDE OXALIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ (en) Park S. Nobel (dir.), Ali Nefzaoui et Hichem Ben Salem, Cacti, Biology and Uses, University of California Press, 2002, 281 p. (ISBN 0-520-23157-0), p. 202
- ↑ (en) Maryadele J. O'Neil, Ann Smith, Patricia E. Heckelman et Susan Budavari, The Merck Index: An Encyclopedia of Chemicals, Drugs and Biologicals, 13th edition, MERCK & CO INC, 2001, 2564 p. (ISBN 0911910131), partie 6980
Voir aussi
Articles connexes
Liens externes
- Les pathologies inhérentes à l'acide oxalique dans l'encyclopédie médicale Vulgaris et la discussion à propos de l'acide oxalique sur son forum.[1]
- Portail de la chimie
Catégories : Produit chimique nocif | Produit chimique corrosif | Acide dicarboxylique | Produit chimique domestique | Apiculture | Agent chélatant
Wikimedia Foundation. 2010.


