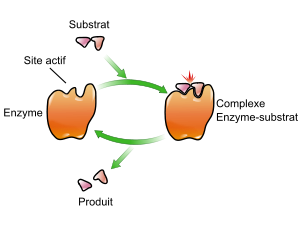
- Complexe d'enzymes
-
Enzyme
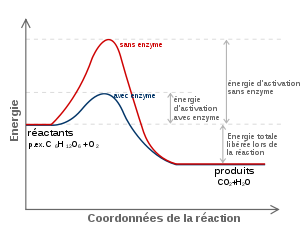
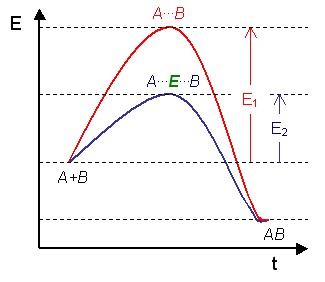 Figure 1: Diagramme d'une réaction catalytique qui montre l'énergie (E) requise à différentes étapes suivant l'axe du temps (t). Les substrats (A et B) en conditions normales requièrent une quantité d'énergie considérable (E1) pour atteindre l'état de transition A...B, à la suite duquel le produit de réaction (AB) peut se former. L'enzyme (E) crée un microenvironnement dans lequel A et B peuvent atteindre l'état de transition (A...E...B) plus facilement, réduisant ainsi la quantité d'énergie requise (E2). Comme il est plus aisé d'atteindre un niveau énergétique inférieur, la réaction peut avoir lieu plus fréquemment, ce qui se traduit par une vitesse de réaction accrue.
Figure 1: Diagramme d'une réaction catalytique qui montre l'énergie (E) requise à différentes étapes suivant l'axe du temps (t). Les substrats (A et B) en conditions normales requièrent une quantité d'énergie considérable (E1) pour atteindre l'état de transition A...B, à la suite duquel le produit de réaction (AB) peut se former. L'enzyme (E) crée un microenvironnement dans lequel A et B peuvent atteindre l'état de transition (A...E...B) plus facilement, réduisant ainsi la quantité d'énergie requise (E2). Comme il est plus aisé d'atteindre un niveau énergétique inférieur, la réaction peut avoir lieu plus fréquemment, ce qui se traduit par une vitesse de réaction accrue.Une enzyme est une molécule (protéine ou ARN dans le cas des ribozymes) permettant d'abaisser l'énergie d'activation d'une réaction et d'accélérer jusqu'à des millions de fois les réactions chimiques du métabolisme se déroulant dans le milieu cellulaire ou extracellulaire sans modifier l'équilibre formé . Les enzymes agissent à faible concentration et elles se retrouvent intactes en fin de réaction : ce sont des catalyseurs biologiques (ou biocatalyseurs). La première enzyme fut découverte par Anselme Payen et Jean-François Persoz en 1833[1]. Après avoir traité un extrait aqueux de malt à l'éthanol, ils ont précipité une substance sensible à la chaleur. Cette substance était capable d'hydrolyser l'amidon : ils l'ont nommée diastase (étym. : diastasis = séparation) car elle séparait le sucre soluble de l'amidon. On l'appelle aussi α -amylase (alpha-amylase).
La nomenclature des enzymes n'est pas standardisée mais, par convention, elle se compose le plus souvent d'un radical proche du substrat ou du produit de la catalyse suivi du suffixe « ase ». Par exemple :
- Le glucose oxydase est une enzyme qui catalyse l'oxydation du glucose.
- L'amidon synthétase catalyse la synthèse de l'amidon.
Une enzyme, comme toute protéine, est synthétisée par les cellules vivantes à partir des informations codées dans l'ADN ou dans l'ARN dans le cas de certains virus. Il existe plus de 3 500 enzymes différentes répertoriées.
Les premières enzymes isolées furent d'abord nommées ferments solubles, diastases ou zymases.
Il existe deux grandes catégories d'enzymes : les enzymes purement protéiques (qui ne sont constituées que d'acides aminés) : les holoenzymes et les enzymes qui sont en deux « parties » :
L'association de la partie protéique (apoenzyme) et de la partie non-protéique (cofacteur) constitue « l'hétéroenzyme ».
Sans la coenzyme, la catalyse de la réaction ne peut avoir lieu.
Exemple : L'AminoAcyl transférase (enzyme fixant l'acide aminé sur l'ARN transfert) a besoin d'ATP (coenzyme) pour fixer l'acide aminé sur l'ARNt.
Sommaire
Le site actif
Article détaillé : site actif.La fonction des enzymes est liée à la présence dans leur structure (secondaire et tertiaire) d'un site particulier appelé le site actif. Schématiquement, il a la forme d'une cavité ou d'un sillon dans lequel vont se fixer les substrats grâce à plusieurs liaisons chimiques faibles. Une fois fixés, les substrats vont réagir et se transformer en produit.
Le site actif est subdivisé en deux parties : le site de liaison/fixation/reconnaissance (qui reconnaît la complémentarité de forme avec un substrat spécifique à l'enzyme) et le site catalytique (qui permet la réaction transformant le substrat en produit).
La « Vitesse initiale » de réaction enzymatique
La vitesse de réaction enzymatique est mesurée à partir de la quantité de produit formé ou de réactif disparu par unité de temps.
L'affinité de l'enzyme pour son substrat est donnée par son Km ou constante de Michaelis dans le cas d'une enzyme simple, à un seul site de fixation (enzyme dite michaélienne). Celle-ci est définie comme la concentration de substrat pour laquelle la vitesse de réaction enzymatique est la moitié de la vitesse de réaction maximale.
De nombreux facteurs peuvent modifier la vitesse de réaction enzymatique :
- les concentrations en enzyme et en substrat ;
- les concentrations en ions métalliques (inhibiteurs compétitifs);
- les caractéristiques physico-chimiques du milieu de réaction (température, pH, ...) ;
- la présence d'inhibiteurs de la réaction enzymatique.
La réaction enzymatique dépend des caractéristiques physico-chimiques du milieu de réaction :
- la température : en conditions optimales, elle doit approcher en général les 37 à 38 °C. Ces valeurs sont indicatives d'enzymes d'animaux à sang chaud, soit presque la température du corps. À l'inverse, si la température dépasse les 60 °C, l'enzyme est dénaturée (rupture des liaisons hydrogènes situées dans des parties variables de la protéine), il y a modification du site actif, et la réaction ne peut pas avoir lieu. Si la température est en dessous de 5 °C, l'enzyme est inactivée car l'agitation moléculaire provoquée par la chaleur est limitée : les molécules de substrat et les enzymes se rencontrent difficilement. Il existe des enzymes thermostables, telles que par exemple l'ADN polymérase utilisée dans la PCR.
- le pH : selon les réactions, le complexe E/S devra se faire le plus proche possible du pHi (ou pH isoelectrique) plus vite à pH neutre, comme pour l'hydrolyse de l'amidon, à pH acide, environ 2, pour la pepsine par exemple, ou encore à pH basique, 8 pour la trypsine. L'état de protonation soit du site actif soit du site de liaison peut en effet être critique dans l'activité de l'enzyme. À l'inverse, certaines enzymes sont relativement peu sensibles aux variations de pH. Néanmoins, sous un pH "extrême" (13-14) l'enzyme est dénaturée comme pour une température dépassant 60 °C.
La régulation de l'activité enzymatique
Réguler l'activité des enzymes permet de réguler le métabolisme de la cellule. Cette activité dépend fortement de la conformation de l'enzyme (et donc de la forme de ses sites), qui peut être modifiée via des phosphorylations et des déphosphorylations.
Certaines enzymes sont actives quand elles sont phosphorylées, d'autres quand elles sont déphosphorylées. Ce sont d'autres enzymes qui régulent les phosphorylations et déphosphorylations : les kinases permettent de transférer un groupement phosphate sur leur substrat, alors que les phosphatases enlèvent un groupement phosphate à leur substrat.
La phosphorylation/déphosphorylation est une régulation où l'enzyme est modifié de façon covalente. Un autre type de régulation importante qui n'implique que la fixation réversible d'un effecteur est l'allostérie.
Classement et dénomination des enzymes
Les enzymes sont classées en six principaux groupes, en fonction du type de réaction qu'elles catalysent :
- oxydo-réductases (E.C.1) ;
- transférases (E.C.2) ;
- hydrolases (E.C.3) ;
- lyases (E.C.4) ;
- isomérases (E.C.5) ;
- ligases ou synthétases (E.C.6).
Les enzymes sont généralement nommées en additionnant le suffixe -ase au nom de leur substrat, et elles sont classifiées par un système numérique standard. Leur numéro est attribué par l' « Enzyme Commission » (EC) voir classification EC.
Terminologie
- enzyme allostérique : enzyme multimérique dont l'activité est régulée par une molécule non substrat.
- enzyme de la transformation alimentaire : enzyme employée pour contrôler la texture, le goût, l’aspect ou la valeur nutritive des aliments. Les amylases dégradent les complexes polysaccharidiques en sucres plus simples ; et les protéases « attendrissent » les protéines de la viande. Un objectif important de la biotechnologie alimentaire est le développement de nouvelles enzymes alimentaires améliorant la qualité de la transformation des aliments.
- enzyme de restriction ou endonucléase de restriction : classe d’enzymes qui coupent l'ADN après avoir reconnu une séquence spécifique. Les trois types d’endonucléase de restriction sont :
- enzyme inductible : enzyme qui est synthétisée uniquement en présence du substrat, ou d'une molécule voisine, qui agit comme inducteur ;
- enzyme répressible : enzyme dont l’activité peut être réduite par la présence d’une molécule régulatrice ;
- enzyme limitant la vitesse : enzyme dont l’activité contrôle le rendement du produit final d’une voie métabolique multi-enzymatique... ;
- enzyme constitutive : enzyme dont la concentration dans la cellule est constante et n'est pas influencée par une concentration en substrat.
Pathologie
Les mutations des gènes codant pour des enzymes sont à l'origine des maladies enzymatiques, qui sont pour la plupart des maladies métaboliques.
Voir aussi
Liens internes
- Inhibiteur
- Isoenzyme
- Cinétique enzymatique
- Fermentation
- Oenologie
Liens externes
- (en) BRENDA : base de données sur les enzymes
- Visualisation d'enzymes en 3D
Notes et références
- ↑ Payen et Persoz, « Mémoire sur la diastase, les principaux produits de ses réactions et leurs applications aux arts industriels », Annales de chimie et de physique, 2e série, t. 53, 1833, pp. 73-92, consultable sur Google Books.
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire
- Portail de la microbiologie
Catégories : Métabolisme | Enzyme | Catalyse
Wikimedia Foundation. 2010.