- Inhibiteur (biochimie)
-
Inhibiteur (biochimie)
Un inhibiteur est une substance qui diminue la vitesse d'une réaction catalysée par une enzyme. En se liant sur une enzyme, un inhibiteur peut empêcher la fixation du substrat sur le site actif, ou provoquer une déformation de l'enzyme qui rend celle-ci inactive (inhibiteur allostérique). L'inhibition des enzymes joue un rôle important dans le contrôle des mécanismes biologiques, et notamment dans la régulation des voies métaboliques. En enzymologie, les inhibiteurs sont très utilisés pour déterminer le mécanisme d'action d'une enzyme. Des applications existent dans de nombreux autres domaines : beaucoup de médicaments, pesticides ou insecticides sont des inhibiteurs enzymatiques.
L'affinité d'un inhibiteur pour une enzyme est donnée par la constante d'inhibition Ki, qui représente la concentration en inhibiteur pour laquelle la moitié des sites enzymatiques sont occupés. Ainsi, l'affinité d'un inhibiteur est d'autant plus grande que le Ki est petit. Cette constante d'inhibition, exprimée en mole par litre correspond aussi à la constante de dissociation du complexe enzyme-inhibiteur.
On distingue généralement les inhibiteurs réversibles, qui se lient à l'enzyme par des liaisons de faible énergie, et les inhibiteurs irréversibles, qui se fixent de manière covalente.
Sommaire
Inhibitions réversibles
Inhibiteur compétitif
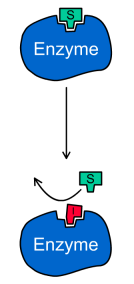
Un inhibiteur compétitif possède généralement une ressemblance structurale avec le substrat et tous deux entrent en compétition pour se fixer sur le même site enzymatique (=effet isostérique). La réaction enzymatique est bloquée, soit parce que l'inhibiteur ne possède pas le groupement chimique transformé par l'enzyme, soit parce que la position de groupement chimique sur l'inhibiteur rend impossible sa reconnaissance par le site actif.
Certains inhibiteurs compétitifs ne sont pas des analogues du substrat, et leur mode d'action est différent. L'inhibiteur ne se fixe pas sur le site actif, mais sur un autre site de liaison de l'enzyme. La fixation de l'inhibiteur entraîne une modification de la conformation du site de liaison du substrat, empêchant la reconnaissance entre l'enzyme et le substrat. Inversement, la liaison du substrat sur l'enzyme empêche la fixation de l'inhibiteur: ces deux molécules s'excluent mutuellement.
Schéma et équation de Michaelis-Menten dans le cas d'une inhibition compétitive :
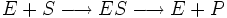
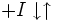
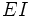
![v_0=\frac{V_{max}[S]}{[S]+K_m(1+\frac{[I]}{K_i})}](/pictures/frwiki/56/8fecd77cc87707c5a13d162b814cfddc.png)
Par rapport à l'équation classique de Michaelis-Menten, la vitesse maximale de la réaction reste inchangée, mais l'affinité de l'enzyme pour le substrat diminue car ce dernier ne peut pas se lier au complexe enzyme-inhibiteur. Dans le cas d'une inhibition compétitive, il est possible de lever l'inhibition en saturant l'enzyme en substrat.
Inhibiteur incompétitif
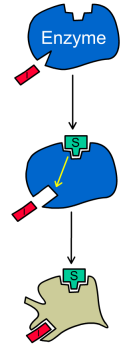
Un inhibiteur incompétitif ne se lie sur l'enzyme qu'après fixation du substrat et empêche la formation des produits. Généralement, la liaison du substrat sur l'enzyme entraîne une modification de la conformation de l'enzyme, révélant ainsi un site de fixation pour l'inhibiteur. L'inhibiteur, en retour, modifie la conformation du site actif de l'enzyme, et empêche la réaction.
Comme son nom l'indique, un inhibiteur incompétitif n'entre pas en compétition avec un substrat sur son site de fixation. En revanche, dans les réactions enzymatiques à plusieurs substrats, les inhibiteurs incompétitifs peuvent se fixer sur le site de liaison d'un des substrats.
Schéma et équation de Michaelis-Menten dans le cas d'une inhibition incompétitive :
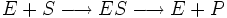
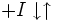
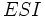
![v_0=\frac{\frac{V_{max}}{(1+\frac{[I]}{K_I})}[S]}{[S]+\frac{K_m}{(1+\frac{[I]}{K_I})}}](/pictures/frwiki/100/def74c9ce2e11556abe5f254555752fa.png)
La vitesse maximale de la réaction diminue, mais l'affinité apparente de l'enzyme pour le substrat augmente. En effet, la formation du complexe enzyme-substrat-inhibiteur diminue le nombre de complexes ES et, d'après la Loi d'action de masse, favorise la liaison du substrat sur l'enzyme. Les effets d'un inhibiteur incompétitif ne se manifestent pas pour de faibles concentrations en substrat, l'enzyme étant majoritairement sous forme libre. Ainsi, ce type d'inhibition ne peut pas être levé en augmentant la concentration du substrat.
Inhibition par le substrat
L'inhibition par le substrat est un cas particulier de l'inhibition incompétitive où deux molécules de substrat peuvent se lier à l'enzyme, mais ne peuvent pas être transformées en produit.
Schéma et équation de Michaelis-Menten dans le cas d'une inhibition par le substrat :
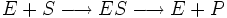
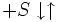
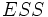
![v_0=\frac{V_{max}[S]}{[S]+K_m+\frac{[S]^2}{K_I}}](/pictures/frwiki/102/fb60265a5b3d68f3c7da8782b91d6e4a.png)
Inhibiteur non compétitif
Un inhibiteur non compétitif peut se lier à la fois, et avec une même affinité, sur l'enzyme libre et sur l'enzyme liée au substrat. Cependant, l'inhibiteur et le substrat n'entrent pas en compétition pour se fixer sur un même site : le substrat se lie au site actif, et l'inhibiteur à un autre site de fixation. L'inhibiteur entraîne une modification de la conformation du site actif, ce qui empêche la transformation du substrat en produit mais n'influe pas sur la reconnaissance entre l'enzyme et le substrat.
Schéma et équation de Michaelis-Menten dans le cas d'une inhibition non compétitive :
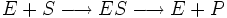

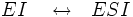
![v_0=\frac{\frac{V_{max}}{(1+\frac{[I]}{K_i})}[S]}{[S]+K_m}](/pictures/frwiki/55/728c978902380b3cea92221ac1c0a726.png)
La fixation d'un inhibiteur non compétitif diminue la vitesse maximale de la réaction, mais ne modifie pas l'affinité de l'enzyme pour le substrat, car ce dernier se lie aussi bien à l'enzyme libre qu'au complexe EI.
Une inhibition non compétitive ne peut pas être levée par une augmentation de la concentration en substrat, puisque l'inhibiteur se lie aussi bien sur l'enzyme libre que sur le complexe ES.
Inhibition mixte
L'inhibition mixte est une généralisation des inhibitions précédentes dans laquelle l'inhibiteur se lie à la fois avec l'enzyme libre et avec l'enzyme liée au substrat, mais avec des affinités différentes : Ki ≠ KI. On distingue deux types d'inhibitions mixtes : l'inhibition compétitive - non compétitive (KI > Ki) et l'inhibition non compétitive - incompétitive (KI > Ki).
Schéma et équation de Michaelis-Menten dans le cas d'une inhibition mixte :
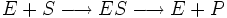

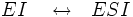
![v_0=\frac{\frac{V_{max}}{(1+\frac{[I]}{K_I})}[S]}{[S]+K_m\frac{1+\frac{[I]}{K_i}}{1+\frac{[I]}{K_I}}}](/pictures/frwiki/48/06198ddd6bb8ccaf9607e3f710efe7cd.png)
Comme le montre le tableau suivant, en faisant varier les constantes d'inhibition Ki et KI, on retrouve les formules précédentes sur l'inhibition compétitive, incompétitive et non compétitive, qui sont des cas extrêmes de l'inhibition mixte.
Type d'inhibition Km apparent Vmax apparente KI → infini compétitive ![K_m(1+\frac{[I]}{K_i})](/pictures/frwiki/99/c12d854d7f3dea9fa13789cb40efb593.png)
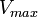
Ki → infini incompétitive ![\frac{K_m}{(1+\frac{[I]}{K_I})}](/pictures/frwiki/49/1a04404f326403f214b23a0e8c6d3e6a.png)
![\frac{V_{max}}{(1+\frac{[I]}{K_I})}](/pictures/frwiki/98/b4ea8f0a134659479310e44e9b2934be.png)
Ki = KI non compétitive 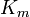
![\frac{V_{max}}{(1+\frac{[I]}{K_i})}](/pictures/frwiki/49/1b261e7f8156c3129bf5b99df746de04.png)
KI ≠ Ki mixte ![\frac{K_m(1+\frac{[I]}{K_i})}{(1+\frac{[I]}{K_I})}](/pictures/frwiki/97/aabd6699a9064065afde58e643dad7b8.png)
![\frac{V_{max}}{(1+\frac{[I]}{K_I})}](/pictures/frwiki/98/b4ea8f0a134659479310e44e9b2934be.png)
Inhibition irréversible, inhibition « suicide »
L'inhibition suicide est un mécanisme où l'inhibiteur forme un complexe stable avec l'enzyme qui l'inactive de façon permanente. L'enzyme reconnait l'inhibiteur comme son substrat et entame le processus de modification de ce dernier. Intervient alors une étape au cours de laquelle l'inhibiteur modifié devient très réactif et se lie de façon très stable à l'enzyme. L'enzyme contribue ainsi à sa propre inactivation irréversible d'où le nom d'inhibition « suicide ».
Exemples:
- L'aspirine (=acetylsalicylate) inhibe la cyclooxygénase active.
- La pénicilline est un inhibiteur suicide de la transpeptidase intervenant dans la synthèse du peptidoglycane, composant de la paroi des bactéries. Son cycle bêta-lactame étant très labile réagit avec le site actif de l'enzyme. Elle se fixe alors de façon thermodynamiquement très stable à l'enzyme au niveau de ce dernier.
Voir aussi
- Équation de Michaelis-Menten
- Constante de Michaelis
- Vitesse initiale maximale
- Vitesse initiale
- Allostérie
- Portail de la biologie
Catégorie : Enzymologie
Wikimedia Foundation. 2010.
