- Iodate de sodium
-
Iodate de sodium 
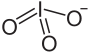
Structure de l'iodate de sodium.Général No CAS No EINECS SMILES InChI Apparence cristaux blancs Propriétés chimiques Formule brute NaIO3 Masse molaire[1] 197,8924 ± 0,0009 g·mol-1
I 64,13 %, Na 11,62 %, O 24,25 %,Propriétés physiques T° fusion 425 °C Solubilité 947 mg·l-1 Masse volumique 4,28 g·cm-3 Précautions Directive 67/548/EEC[2] 
Xn
OPhrases R : 8, 22, 42/43, Phrases S : 17, 22, 36/37, 45, Transport[2] - 1479 SGH[2] 

DangerUnités du SI & CNTP, sauf indication contraire. L’iodate de sodium est un composé chimique de formule NaIO3. C'est un sel de l'acide iodique HIO3. C'est un agent oxydant et donc un comburant responsable d'incendies lorsqu'il est en contact avec des matériaux combustibles ou des agents réducteurs.
Préparation
L'iodate de sodium peut être obtenu en faisant réagir de l'acide iodique avec une base contenant de l'iode :
On l'obtient également en ajoutant du diiode I2 à une solution chaude et concentrées d'hydroxyde de sodium NaOH ou d'un carbonate de sodium Na2CO3 :
Réactions
L'iodate de sodium peut être oxydé en periodate de sodium NaIO4 par des solutions aqueuses d'hypochlorite ClO- ou d'autres agents oxydants énergiques :
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- SIGMA ALDRICH

