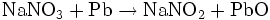- Nitrite De Sodium
-
Nitrite de sodium
Nitrite de sodium 
Général Nom IUPAC Nitrite de sodium No CAS No EINECS No E E250 Apparence solide de formes variables hygroscopique, blanc a jaune.[1] Propriétés chimiques Formule brute NaNO2 Masse molaire 68,9953 g∙mol-1
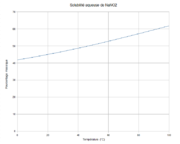
N 20,3 %, Na 33,32 %, O 46,38 %,Propriétés physiques T° fusion (décomposition) : 280 °C[1] T° ébullition Se décompose au-dessous du point d'ébullition à 320 °C[1] Solubilité dans l'eau à 20 °C : 82 g/100 ml[1] Masse volumique 2.2 g/cm³[1] Précautions Directive 67/548/EEC 
T
O
NPhrases R : 8, 25, 50, Phrases S : (1/2), 45, 61, Transport - 1500 SGH[2] 


DangerÉcotoxicologie DL50 85 mg·kg−1 (rats) Unités du SI & CNTP, sauf indication contraire. Le nitrite de sodium, de formule NaNO2, est le nitrite le plus important dans l'industrie chimique.
La masse molaire moyenne du nitrite de sodium est : 69,00 g.mol-1. L'ancienne méthode de fabrication était basée sur la réduction du nitrate de sodium par le plomb métallique à 420 °C :
On l'obtient de nos jours comme sous-produit lors de la synthèse industrielle de l’acide nitrique : on fait absorber à une solution d’hydroxyde de sodium un mélange de monoxyde d'azote et de dioxyde d'azote.
Sommaire
Utilisations
Antidote lors d'intoxication au cyanure
Le nitrite de sodium est injecté par voie intra-veineuse immédiatement après l'ingestion accidentelle de cyanure. Il permet alors de minimiser la fixation des cyanures au Fe(II) de l'hémoglobine (très forte affinité) par formation de méthémoglobine (le fer de l'hème est oxydé à l'état de Fe(III)), dont l'affinité pour les ions cyanures est alors diminuée. Semble avoir été interdit par la Belgique comme conservateur de charcuterie emballée : haute toxicité (cancérigène) sur les rats.
Alimentaire
Le nitrite de sodium est un additif alimentaire utilisé comme agent conservateur (E250[3]).
Références
- ↑ a , b , c , d et e NITRITE DE SODIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ (en) Noms de catégorie et système international de numérotation des additifs alimentaires - Codex Alimentarius
Voir aussi
Liens externes
- (fr) Service du répertoire toxicologique de la CSST
- Portail de la chimie
Catégories : Composé du sodium | Produit chimique toxique | Produit chimique comburant | Produit chimique dangereux pour l'environnement | Nitrite | Agent conservateur
Wikimedia Foundation. 2010.