- 200-821-6
-
Cyanure
 Pour les articles homonymes, voir CN.
Pour les articles homonymes, voir CN.Cyanure 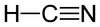
Général No CAS No EINECS SMILES InChI Propriétés chimiques Formule brute CN [Isomères] Masse molaire 26,0174 g∙mol-1
C 46,16 %, N 53,84 %,Propriétés physiques T° fusion -87,99 °C T° ébullition 48,73 °C Pression de vapeur saturante 740 mmHg a 25 °C Unités du SI & CNTP, sauf indication contraire. Les cyanures sont les composés de l'anion CN-, formé d'un atome de carbone lié par une liaison triple à un atome d'azote.
- Structure (ou formule) de Lewis : -|C≡N|
- réaction acido-basique : H-C≡N = N≡C- + H+
Sommaire
Formes
Les sels de cet ion sont extrêmement toxiques, de même que l'acide qui leur est associé : l'acide cyanhydrique. Dans le langage courant, on utilise souvent le terme cyanure pour désigner le cyanure de potassium (KCN).
Les ferrocyanures (ou hexacyanoferrates II) Fe(CN)64 -, en revanche, sont pratiquement inoffensifs. Les ferrocyanures de calcium, de sodium et de potassium sont des additifs alimentaires (anti-agglomérants) respectivement référencés E 538, E 535 et E 536.
Le ferrocyanure de potassium est autorisé pour le collage des vins blancs ou rosés présentant des excès de fer en vue d'une mise en bouteilles[1] en raison de sa capacité à faire précipiter les métaux (fer et cuivre notamment) responsables de casses. Ce traitement est à l'origine de la création du diplôme national d'œnologie en 1955 car les pouvoirs publics ont alors estimé qu'il était nécessaire de former des techniciens compétents et responsables pour réaliser l'opération. Le déferrage des vins rouges par collage au ferrocyanure de potassium est interdit car il est impossible de contrôler l'absence de résidus de fer (dissous ou en suspension) dans le vin du fait de la coloration du vin liée à la présence d'anthocyanes.
Historiquement, le collage au ferrocyanure de potassium des vins présentant des sucres résiduels était pratiqué et permettait de réduire la teneur du vin en micronutrients utilisables par les levures responsables de refermentations spontanées.
Les ferricyanures (ou hexacyanoferrates III) Fe(CN)63- présentent également une faible toxicité.
Source et utilisation
Dans la nature
Les cyanures peuvent être produits par des bactéries, des moisissures et des algues et sont contenus dans de nombreux aliments et des plantes. Dans les plantes, les cyanures sont normalement liés à des molécules de sucre sous la forme de glycosides cyanogènes et servent aux plantes comme défense contre les herbivores. Les racines du manioc ou encore les graines de lin contiennent des glucosides cyanogènes et, souvent, il faut les traiter avant la consommation (en général par ébullition prolongée). Les noyaux de fruits, comme les cerises et les abricots, contiennent souvent des cyanures ou des glycosides cyanogènes. Les pépins de pomme en contiennent également. Les amandes amères dont on fait de l'huile d'amande contiennent aussi un glycoside cyanogène, l'amygdaline. L'ingestion de 50 amandes amères peut causer la mort d'un homme[2]. Beaucoup d'enzymes hydrogénases contiennent des ligands cyanurés sur leurs sites actifs.
Selon l'Agence canadienne d'inspection des aliments[3], le glycoside cyanogène contenu dans ces amandes devient toxique lorsqu'il se transforme en acide cyanhydrique dans le corps. La dose létale de cyanure se situe entre 0,5 et 3,0 mg par kg de poids corporel.
Chimie
Le cyanure est un anion qui est souvent rencontré en chimie.
Chimie de coordination
Le cyanure est considéré comme le ligand le plus puissant pour beaucoup de métaux de transition. La grande affinité des métaux pour le cyanure peut être attribuée à sa charge négative et sa capacité à entrer dans une liaison p.
Quelques complexes:
- Les octocyanures [M(CN)8]4-(M= Mo, W) qui ont une forme dodécaédrique ;
- Les hexacyanures [M(CN)6]3- (M = Ti, V, Cr, Mn, Fe, Co), qui ont une forme octaédrique ;
- les tétracyanures [M(CN)4]2- (M = Ni, Pd, Pt), qui ont une forme carrée plane ;
- les dicyanures [M(CN)2]- (M = Cu, Ag, Au), qui ont une forme linéaire.
Le pigment bleu foncé Bleu de Prusse, utilisé comme teinture, est un complexe cyanuré du fer. Le bleu de Prusse peut produire du cyanure d'hydrogène par action des acides.
Synthèse organique (voir nitriles)
Très nucléophile, le cyanure est facilement introduit dans des molécules par déplacement de l’halogène correspondant. Les cyanures organiques, en général, sont appelés nitriles. Ainsi, CH3CN peut s'appeler cyanure de méthyle mais, normalement, on parle de acétonitrile. En chimie organique, le cyanure est utilisé pour augmenter la longueur des chaînes organiques en même temps que l'introduction d'autres fonctions:
- RX + CN- → RCN + X- (Substitution nucléophile) suivi de
- RCN + 2 H2O → RCOOH + NH3 (hydrolyse), ou
- RCN + 0.5 LiAlH4 + (seconde étape) 2 H2O → RCH2NH2 + 0.5 LiAl(OH)4 (sous reflux dans de l'éther, suivi de l' addition de H2O)
Une méthode alternative pour introduire le cyanure est l'hydrocyanatation où le cyanure d'hydrogène réagit avec un alkène. Un catalyseur métallique est nécessaire.
Un phénomène peut se produire si la transmutation de la cyanure (substances hyperprotéique du cyanure) et du dicyanure est cataclysée mutuellement et molléculairement entre les deux substances.
Divers
- Les cyanures sont utilisés comme insecticides dans les bateaux et comme raticides.
- Les Professeurs Ernst T. Krebs Senior et Junior avaient proposé l'administration intraveineuse d'amygdaline en chimiothérapie carcinologique. En effet, elle délivre du cyanure sous l'action d'une beta-glycosidase spécifiquement exprimée par certains tissus tumoraux. L'amygdaline IV n'a cependant pas fait la preuve de son efficacité.
- Le cyanure est utilisé dans l'extraction minière et dans l'industrie pour extraire l'or [4] et l'argent en remplacement du mercure.
- Il est utilisé également pour réaliser l'électrodéposition (électrolyse) de certains métaux (argent, or, cadmium, cuivre, mercure…)
- Libéré par le Zyklon B, le cyanure d'hydrogène fut utilisé par les Nazis durant la Seconde Guerre mondiale comme poison dans les chambres à gaz.
- Cyanure est le nom d'un des membres du groupe de hip-hop Français ATK
- Cyanure (Cyanide en anglais) nom d'une chanson de Metallica retrouvée sur l'album Death Magnetic
Sécurité
Toxicité
Article détaillé : Intoxication au cyanure.Le cyanure se fixe sur les atomes de fer contenus dans l'hémoglobine et la cytochrome oxydase. Cette dernière est responsable du transport et de l'utilisation de l'oxygène dans la chaîne respiratoire mitochondriale. Il est à signaler que, si la fixation de cyanure sur l'hémoglobine déplace la courbe de saturation de l'hémoglobine vers la gauche et diminue de ce fait l'extraction d'oxygène par les tissus, ce mécanisme est modeste dans la mort par intoxication au cyanure.
Il est particulièrement redoutable sous forme de cyanure d'hydrogène, composé volatil et très toxique, qui attaque directement les poumons. Ce gaz se forme notamment lorsque les cyanures sont acidifiés (en solution ou par les sucs gastriques après ingestion). Il est utilisable pour ses propriétés anoxiantes comme arme chimique.
L'intoxication au cyanure peut se produire simplement lors de l'ingestion de certaines plantes (cassave, manioc…) et de noyaux de certains fruits. Ces derniers contiennent une molécule de cyanogène, l'amygdaline, décomposée dans l'intestin en glucose, aldéhyde et cyanure, sous l'effet des bêta-glucosidases. L'amande amère possédant elle-même une bêta-glucosidase activée à l'air, elle libère des effluves de cyanure d'hydrogène et de benzaldéhyde, c'est ce dernier qui dégage l'odeur d'amande amère couramment attribuée au cyanure lui-même.
La combustion de certains polymères (polyuréthanes) a entraîné des intoxications au cyanure et l'utilisation même des sels de cyanure en métallurgie en a accru le risque. Il est admis que, dans beaucoup d'incendies, notamment « feux de lits » (personnes fumant au lit, s'endormant, la cigarette provoquant une combustion lente des couvertures), les fumées peuvent contenir beaucoup de cyanures, ce qui explique que l'on trouve assez fréquemment des victimes décédées par intoxication avant d'être brûlées.
Antidotes
Les antidotes suivants existent :
- nitrite d'amyle associé au nitrite de sodium et au thiosulfate de sodium ;
- l'hydroxocobalamine, qui capte le cyanure pour conduire à la vitamine B12, atoxique et excrétée par les urines.
- sels de cobalt
Il est nécessaire de réagir vite et, en cas d'arrêt respiratoire, de faire respirer de l'oxygène et en aucun cas de pratiquer le bouche à bouche car il y a un risque d'intoxication à l'expiration. Sous l'action de la chaleur le cyanure ne représente aucun danger.
Nomenclature
- numéro CAS : 151-50-8
- fiche toxicologique INRS : FT111
- numéro CAS : 143-33-9
- fiche toxicologique INRS : FT111
Histoire
- À l'issue de la Seconde Guerre mondiale plusieurs nazis se sont suicidés en ingérant une capsule de cyanure, notamment Richard Glücks (1889-1945), Heinrich Himmler (1900-1945) et Hermann Göring (1893-1946) ; Magda Goebbels (1901-1945) a tué ses six enfants et s'est suicidée aussi à l'aide d'ampoules de cyanure.
- La tentative d'empoisonner Raspoutine au cyanure échoua, mais on ignore s'il avait eu recours à la mithridatisation ou si le cyanure avait réagi à la cuisson avec le sucre du gâteau où il avait été placé.
- 914 adeptes de la secte le Temple du Peuple sont décédés par absorption de cyanure lors d'un suicide collectif en 1978.
Notes et références
- ↑ [1]
- ↑ Guide pratique de toxicologie, F.-X. Reichl, R. Perraud, Ed. Krahé, 2004, p.134.
- ↑ Agence canadienne dinspection des aliments - Toxines naturelles dans les fruits et légumes frais
- ↑ Cyanuration et Or : Dissolution par l'eau ? : un article explicatif chez Culturesciences-Chimie Ecole Normale Supérieure - DGESCO
A voir
Liens internes
Lien externe
- Portail de la chimie
Catégories : Anion | Cyanure
Wikimedia Foundation. 2010.
