- Thiosulfate de sodium
-
Thiosulfate de sodium 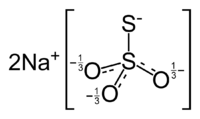
Général No CAS No EINECS No E E539 Apparence Poudre blanche Propriétés chimiques Formule brute Na2S2O3 Masse molaire[1] 158,108 ± 0,011 g·mol-1
Na 29,08 %, O 30,36 %, S 40,56 %,Propriétés physiques Solubilité 501 g·l-1 à 0 °C
701 g·l-1 à 20 °C
2 450 g·l-1 à 80 °CMasse volumique 1,667.10³ kg/m³ (solide) Précautions Directive 67/548/EEC[2] Phrases R : 36, 37, 38, Phrases S : 26, 36, SIMDUT[3] Produit non contrôlé Unités du SI & CNTP, sauf indication contraire. Le thiosulfate de sodium est constitué d’ions sodium et d’ions thiosulfate S2O32-. C’est la forme basique de l’acide thiosulfurique H2S2O3, instable en milieu aqueux. L’ion thiosulfate possède une forme tétraédrique. Il dérive formellement de l'ion sulfate par remplacement d’un O par un S. Il fait partie de la grande famille des oxoanions du soufre avec les ions sulfite, disulfite, dithionite, peroxodisulfate, disulfate, dithionate, et polythionate[4]. Les deux valences de l’élément chimique de l’ion S2O32- sont différentes. Suivant la forme de résonance, les degrés d’oxydation du soufre sont 0 et IV, ou –I et V.
Les utilisations du thiosulfate de sodium sont nombreuses. La solubilité dans l'eau du sel pentahydraté (forme commerciale usuelle) est énorme (voir encadré ci-contre) et sa dissolution est endothermique.
Sommaire
Structure[5]
La longueur des trois liaisons S-O est 147 pm. C'est un peu plus long que dans SO2, (143,1 pm), ce qui est en accord avec le fait que, dans l'ion thiosulfate, la liaison S-O est intermédiaire entre une liaison double (comme dans SO2) et simple.
La longueur de la liaison S-S est 201 pm. Cette longueur est inférieure à la longueur de la liaison simple S-S dans S8 qui est 206,0 pm. Comme précédemment, cette donnée est en accord avec le caractère intermédiaire entre une liaison simple et une liaison double.
Le diamètre effectif de l'ion hydraté en solution aqueuse et 4.10-8cm [6].
Propriétés chimiques
L'ion thiosulfate possède des propriétés d'oxydoréduction, acido-basique et de ligand.
Propriétés d'oxydoréduction
Les propriétés rédox des ions thiosulfate sont assez complexes du fait de la grande variété d'oxoanions du soufre. Par exemple, les réactions de cet ion avec un dihalogène ne sont pas généralisables à tous les dihalogènes.
Les potentiels de références de quelques couples sont[7] :
- H2SO3 / S2O32- : E° = 0,40 V
- SO32- / S2O32- : E° = 0,571 V
- S2O32- / S : E° = 0,5 V
- S4O62- / S2O32- : E° = 0,08 V
Réaction avec I2
Le potentiel de référence du couple S4O62- / S2O32- est E° = 0,09 V/ENH. C'est une valeur intermédiaire dans l'échelle des potentiels. L'utilisation la plus courante de ce couple est avec le diiode. Le potentiel du couple I2 / I- vaut 0,54 V/ENH. Il permet la réaction d'équation
- 2 S2O32- + I2 → S4O62- + 2 I-
L'ion tétrathionate S4O62- qui se forme résulte de la formation d'un pont disulfure -S-S- entre deux ions thiosulfate. Cette observation témoigne du oxydation très douce, avec un seul électron échangé par ion thiosulfate, à la différence de ce qui se passe avec le dichlore (voir ci-dessous).
Cette réaction est rapide et sans réaction concurrente. Elle sert de réaction de base aux titrages iodométriques.
Réaction avec Cl2
Le dichlore Cl2 étant plus oxydant que le diiode I2, la réaction avec les ions thiosulfate est différente. Il se forme du soufre au degré d'oxydation VI sous la forme d'ions hydrogénosulfate HSO4- :
- S2O32- + 4 Cl2 + 5 H2O → 2 HSO4- + 8 Cl- + 8 H+
Pas moins de 8 électrons sont échangés par ion thiosulfate (au lieu de 1 avec le diiode).
Cette réaction est utilisée pour éliminer les traces de dichlore après le blanchiment du linge.
Réaction avec Br2
La réaction du dibrome avec les ions thiosulfate donne à la fois l'ion tétrathionate (comme avec le diiode) et l'ion hydrogénosulfate (comme avec le dichlore). Cette observation est en accord avec le potentiel rédox intermédiaire de ce dihalogène.
Réaction de dismutation
En milieu acide, l'ion thiosulfate, sous forme d'acide thiosulfurique H2S2O3, se dismute. Parmi les produits de la réaction se trouvent[5]
- du soufre, sous la forme habituelle cyclo-S8 mais aussi cyclo-S6
- du dioxyde de soufre SO2
- du sulfure d'hydrogène H2S
- la forme acide de l'ion polysulfure H2Sn
- et de l'acide sulfurique H2SO4
La réaction est donc plus compliquée que l'équation usuellement écrite
- H2S2O3 → S + SO2 + H2O
Réalisation expérimentale
La dismutation se montre en acidifiant, par exemple avec de l'acide chlorhydrique, une solution de thiosulfate de sodium. Suivant la concentration de ces deux réactifs (couramment entre 0,01 M et 0,1 M) le milieu réactionnel se trouble plus ou moins rapidement (quelques minutes à quelques secondes). Ce trouble est du soufre colloïdal.
En conséquence, les réactions utilisant les ions thiosulfate, comme les titrages iodométriques, ne doivent pas être réalisées en milieu acide.
Propriété acidobasique
L'ion thiosulfate est la base conjuguée de l'acide thiosulfurique H2S2O3. Ce dernier se dismutant en solution aqueuse, même à 0°C, ne peut être préparé de cette manière.
En absence d'eau, celui-ci est plus stable. Une autre réaction de décomposition intervient cependant :
- H2S2O3 → SO3 + H2S
C'est formellement la même réaction que la décomposition de l'acide sulfurique
- H2SO4 → SO3 + H2O
Les pKA de l'acide thiosulfurique sont 0,6 et 1,7 [8].
Propriété de ligand
L'ion thiosulfate est également un ligand de cations métalliques. Par exemple, la réaction de complexation des ions argent Ag+ s'écrit[5] :
- Ag+ + 3 S2O32- → Ag(S2O3)32-
La constante de stabilité (en) de ce complexe est telle qu'elle permet la redissolution du bromure d'argent peu soluble AgBr. Cette réaction est utilisée dans le procédé de fixation des photos argentiques.
Quelques constantes de complexation ont été déterminées[9] :
- Pour les complexes constitués d'un cation métallique et d'un seul ligand thiosulfato, le logarithme de la constante de complexation (log ß1) vaut
Ba(S2O8) 2,33 ; Ca(S2O8) 1,91 ; Cd(S2O8) 3,94 ; Co(S2O8) 3,05 ; Fe(II)(S2O8) 0,9 ; Fe(III)(S2O8)+ 2,1 ; Mg(S2O8) 1,79 ; Mn(S2O8) 1,95 ; Ni(S2O8) 2,06 ; Pb(S2O8) 5,1 ; (Sr(S2O8) 2,04 ; Tl(S2O8)- 1,9 ; Zn(S2O8) 2,29.
- Pour les complexes constitués d'un cation métallique et de deux ligands thiosulfato, les logarithmes des constantes de complexation (log ß1) et (log ß2) valent respectivement
Ag(S2O8)- 8,82 et Ag(S2O8)23- 13,5 ; Hg(S2O8) 29, 86 et Hg(S2O8)22- 32,26.
- Pour les complexes constitués d'un cation métallique et de trois ligands thiosulfato, les logarithmes des constantes de complexation (log ß1), (log ß2) et (log ß1), valent respectivement
Cu(I)(S2O8)- 10,3 ; Cu(I)(S2O8)23- 12,2 ; Cu(I)(S2O8)35- 13,8.
Usages
Le thiosulfate de sodium (Sodium thiosulfate appelé anciennement hyposulfite de sodium), de formule Na2S2O3, 5H2O, est un agent fixateur, également utilisé pour neutraliser l'effet de biocides tels que le chlore, l'iode ou le brome, voire d'autres oxydants.
Il est également utilisé en photographie pour la réalisation de bains de fixateur et dans les laboratoires pour titrer l'eau de Javel. Il est également utilisé pour l'extraction de l'or (procédé par lixiviation en tas). l'usage de thiosulfate de sodium est bien moins agressif pour le milieu naturel que le procédé utilisant le mercure.
Histoire
Lors de la Première Guerre mondiale, des compresses ou capuches de tissus imbibés de ce produit ont servi à neutraliser les premiers gaz de combat, dont le chlore, la difficulté étant de se procurer dans les tranchées des quantités suffisantes de ce produit.
Propriétés
La solvatation du thiosulfate de sodium dans l'eau provoque une réaction endothermique, ce qui signifie que la température du solvant diminuera.
Risques & dangers
il se décompose sous l'action de la chaleur à partir de 45 °C et peut réagir vivement en présence de nitrites et peroxydes (risque d'explosion). En présence d'acides, il peut y avoir formation d'oxydes de soufre dangereux[10].
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Fiche sécurité
- « Thiosulfate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- http://en.wiktionary.org/wiki/polythionate
- Greenwood N. & Earnshaw A. (2003). Chemistry of the elements, Ed. Elsevier. p.714
- Bernard M. & Busnot F. Usuel de chimie générale et minérale. Ed. Dunod Paris 1996 p.161
- Bernard M. & Busnot F. Usuel de chimie générale et minérale. Ed. Dunod Paris 1996 p.195
- Bernard M. & Busnot F. Usuel de chimie générale et minérale. Ed. Dunod Paris 1996 p.175
- Bernard M. & Busnot F. Usuel de chimie générale et minérale. Ed. Dunod Paris 1996 p.210
- Fiche sécurité
Voir aussi
Catégories :- Composé du sodium
- Thiosulfate
Wikimedia Foundation. 2010.
