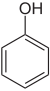
- Phénol (groupe)
-
 Pour les articles homonymes, voir Phénol.
Pour les articles homonymes, voir Phénol.
En chimie organique, les phénols sont des composés chimiques aromatiques portant une fonction hydroxyle -OH. Les dérivés portant plusieurs fonctions -OH sont appelés des polyphénols.Sommaire
Origine
Ce sont des alcools aromatiques qui proviennent des végétaux. Les phénols simples, déchets du métabolisme végétal, sont assemblés en polyphénols comme la lignine. Les composés phénoliques définissent un ensemble de substances que l’on a appelées pendant longtemps " matières tannoïques " d’une façon générale et imprécise parce qu’on ne connaissait pas, avec suffisamment de précision, la nature de ces substances. Il y a quatre principales familles de composés phénoliques : les acides-phénols, les flavones, les anthocyanes, les tanins.
Propriétés acido-basiques
Les phénols sont plus acides que les alcools. En effet, un ion phénolate est stabilisé par résonance et est plus stable qu'un ion alcoolate. En effet, lors de la prise du proton du groupement hydroxyle, le doublet électronique est partagé sur quatre carbones; ainsi, la charge est délocalisée sur autant de carbones et l'ion est beaucoup plus stable que sur un alcool où la charge négative serait trop importante et s'approprierait le proton laissé immédiatement après.
Cet acide est toutefois un acide relativement faible; en conséquence, sa base conjuguée, l'ion phénolate, est une base très forte.
Les propriétés plus acides des phénols font en sorte qu'ils réagissent avec les bases fortes comme le NaOH (hydroxyde de sodium), comparativement aux alcools. Ainsi, cette propriété peut être utilisée pour séparer un mélange d'alcool et de phénol.
Nomenclature
Les éléments de base de la famille portent des noms d'usage :
- le terme le plus simple porte le nom de phénol :
Substitutions électrophiles
Le groupe -OH a un effet « activant » qui facilite les substitutions électrophiles. Le remplacement (substitution) d'un atome d'hydrogène H du cycle benzénique par un autre atome ou groupe d'atomes se porte préférentiellement sur les positions 2, 4 et 6 (par rapport au groupe -OH) de ce cycle :
Quelques substitutions :
1. La nitration du phénol conduit au 2,4,6-trinitrophénol.
2. Alkylation des phénols. Exemple : réaction entre deux molécules de phénol et une molécule de méthanal CH2=O ; dans l'état final de la réaction, le groupe méthylène - CH2 - issu du méthanal s'est substitué à un H en position 2, 4 ou 6 de chaque molécule de phénol (position 2 de la première molécule et position 6 de la seconde dans l'illustration ci-dessous). Le groupe méthylène - CH2 - unit les deux cycles benzéniques ; on est en présence d'une réaction de condensation avec expulsion d'une molécule d'eau.
Cette réaction est la première étape d'une polymérisation qui peut se poursuivre grâce à l'existence des trois sites réactifs (ou sites actifs) 2, 4 et 6 sur chaque molécule de phénol (fonctionnalité[1] égale à 3), il se constitue alors un réseau tridimensionnel[2] (voir phénoplaste).
Composés phénolés
Citons pour mémoire quelques autres composés phénolés :
- Le phénol, le composé de base du groupe, utilisé comme désinfectant et pour la synthèse chimique.
- L'acide salicylique, un médicament analgésique, antipyrétique et anti-inflammatoire, précurseur de l'aspirine.
- Les cannabinoïdes, constituants actifs du cannabis.
- La psilocybine, un alcaloïde hallucinogène des champignons Psilocybe.
- La capsaïcine, le composé corrosif du piment du Chili.
- La tyrosine, un acide aminé.
- Les neurotransmetteurs sérotonine, dopamine, adrénaline et noradrénaline.
- Le levodopa, un médicament qui traite la maladie de Parkinson.
- L'estradiol et les autres œstrogènes.
- Le diéthylstilbestrol, un œstrogène de synthèse à structure de stilbène.
- Le salicylate de méthyle, le constituant principal de l'essence de wintergreen.
- Le gaïacol (2-méthoxyphénol) du café torréfié, du whisky et de la fumée qui a une saveur de fumée et qui, industriellement, est l'intermédiaire de synthèse de la vanilline.
- Les polyphénols comme les flavonoïdes et les tanins.
- Les chlorophénols comme le 2,4-dichlorophénol.
- L'acide picrique, un explosif.
- Des indicateurs de pH : phénolphtaléine, rouge de phénol, bleu de bromothymol, thymolphtaléine et bleu de bromophénol.
- Les alkylphénols comme le Nonylphénol
Notes et références
- Précis de Matières Plastiques - J.-P. Trotignon et al. - AFNOR, Nathan 1996, pp. 2 et 131 (Nathan : ISBN 2-09-176572-4).
- Paul Arnaud - Cours de chimie organique - Premier cycle universitaire - Dunod 1994 - pp. 312 et 471 (ISBN 2 04 019716 8). Les positions 2 et 6 (par rapport au groupe -OH) sont parfois encore appelées positions ortho et la position 4, position para.
Wikimedia Foundation. 2010.