- Vanilline
-
Vanilline 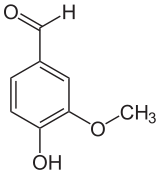
représentations de la molécule de vanilline Général Nom IUPAC 4-hydroxy-3-méthoxybenzaldéhyde Synonymes * Methylprotocatechuic aldehyde
* p-VanillineNo CAS No EINECS PubChem FEMA SMILES Apparence solide blanc
(généralement en aiguilles)Propriétés chimiques Formule brute C8H8O3 [Isomères] Masse molaire[2] 152,1473 ± 0,0079 g·mol-1
C 63,15 %, H 5,3 %, O 31,55 %,pKa 7,40 (25 °C)[1] Propriétés physiques T° fusion 353–354 K (81,5 °C[3]) T° ébullition 558 K (285 °C[3]) Solubilité 10 g·l−1 dans l'eau (25 °C)[3] Masse volumique 1,056 g·cm−3 (solide) Point d’éclair 147 °C Thermochimie Cp Précautions Directive 67/548/EEC Phrases R : 22, Phrases S : 24/25, Écotoxicologie DL50 1 580 mg·kg−1 (rat, oral),
3 925 mg·kg−1 (souris, oral)[3].Classe thérapeutique Antioxidants Composés apparentés Isomère(s) Salicylate de méthyle, Acide mandélique Autres composés Eugénol, Phénol Unités du SI & CNTP, sauf indication contraire. La vanilline est un aldéhyde aromatique naturel qui se développe dans les gousses de vanille lors de la préparation de celles-ci comme épice.
Sommaire
Origine
La vanilline est parmi les composants multiples de l'arôme naturel de la vanille, le plus important et le plus caractéristique. Elle correspond à 2 % de la masse de la gousse. La gousse pesant autour des trois grammes n'en contient donc que 0,06 g. Elle a été extraite pour la première fois à l'état pur par le chimiste Vée. Il procéda par épuisement (extraction) des gousses de vanille dans l'éther, puis après évaporation de l'éther, il épuisa de nouveau le résidu par le bisulfite de sodium. Cette solution est ensuite décomposée par de l'acide sulfurique, épuisée par l'éther; la vanilline se cristallise par évaporation de ce dernier.
Le premier chimiste à avoir synthétisé la vanilline est Wilhelm Haarmann en collaboration avec Ferdinand Tiemann en 1876 mais la disposition moléculaire a été découverte en 1874 .
Odeur
La vanilline a une odeur similaire à la vanille avec un goût sucré[5]. Son intensité aromatique est cependant de 2 à 4 fois moins puissant que celui de l'éthylvanilline[6].
Propriétés physico-chimiques
La molécule est un aldéhyde aromatique, d'où ses autres appellations de vanillaldéhyde ou aldéhyde vanillique. En solution en présence de fer et d'autre composé alcalin, l'aldéhyde développe une couleur rouge et perd son pouvoir odorant[5].
L'éthylvanilline, qui est dérivée de la vanilline (4-hydroxy-3-éthoxybenzaldéhyde), a un pouvoir aromatique beaucoup plus intense grâce à la substitution d'un groupement méthyle (–CH3) sur la liaison éther par un groupement éthyle (–CH2–CH3).
Production et synthèse
La vanilline peut être fabriquée à faible coût par divers procédés, alors que la vanille est très chère à produire et à préparer. C'est ainsi que la production industrielle de la vanilline et son utilisation dans l'alimentation et les parfums sont devenues bien plus importantes que la production et l'usage de la vanille naturelle.
À titre indicatif, un kilo de gousses de vanille entière vaut environ 80 euros quand un kilo de gousses de vanille en poudre vaut dans les 40 euros et qu'un kilo d'arôme artificiel de vanille liquide coûte environ 45 euros.[réf. nécessaire]
Synthèse à partir du gaïacol
Après dissolution du gaïacol dans une solution d'hydroxyde de potassium on fait réagir le tout avec du chloroforme. Cette réaction donne lieu à la formation de vanilline ainsi que d'un isomère la méthoxyaldéhyde salicylique. Les deux composés ainsi formés sont séparés par distillation à la vapeur d'eau sous pression de 2 atmosphères. (chimie du phénol).
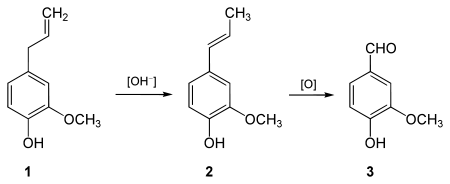
Synthèse à partir de l'eugénol
L'eugénol est extrait du clou de girofle.
L'eugénol (1) est transformé en isoeugénol (2), puis en acétate d'isoeugénol, puis en acétate de vanilline, puis en vanilline.
Synthèse à partir de la lignine
On utilise la lignine récupérée des eaux résiduaires de l'industrie de la pâte à papier. Cette voie de synthèse oxyde les acides lignosulfoniques à l'aide de l'oxydation par voie humide[7].
Oxydation de la curcumine
La curcumine est extraite du curcuma.
Biogénèse à partir des résidus sucriers de la betterave
Le processus aboutit à la formation d'un arôme complexe riche en vanilline. Le procédé n'étant pas chimique, les fabricants considèrent donc qu'il s'agit d'un arôme naturel et qu'ils peuvent l'indiquer comme tel dans la composition des préparations alimentaires, ce qui est plus séduisant pour le consommateur.
Différences avec la vanille
La molécule de vanilline issue de la gousse de vanille est exactement la même molécule que celle fabriquée industriellement.
La différence de qualité provient de la complexité et de la richesse de l'arôme naturel de vanille qui contient de nombreux autres composants, alors que la vanilline obtenue par synthèse est chimiquement pure. Les procédés de biogénèse aboutissent en revanche à la formation d'un arôme complexe, et non à un produit chimiquement pur.
Production mondiale
La vanilline est l'arôme le plus fabriqué dans le monde, devançant de loin le chocolat et le café.
Utilisation
- La vanilline est utilisée pour ses propriétés aromatisantes, soit seule soit en tant que constituant d'un arôme. Il ne faut pas en abuser dans l'arôme car elle possède un goût amer à haute dose. La vanilline (numéro Fema GRAS 3107[5]) est utilisé dans la création d'arôme vanille, chocolat et banane.
- C'est un produit intermédiaire pour la production de plusieurs dérivés à usage pharmaceutique.
- Ses propriétés chimiques la font parfois utiliser dans certaines réactions en chimie analytique.
- On lui attribue également des vertus aphrodisiaques.
- La vanilline sulfurique (mélange dans l'acide sulfurique concentré) est utilisée pour doser les terpènes par méthode colorimétrique
Notes et références de l'article
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) ChemIDplus, « Vanillin USAN - RN: 121-33-5 » sur chem.sis.nlm.nih.gov, U.S. National Library of Medicine. Consulté le 06/10/2008.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 3, Huston, Texas, Gulf Pub. Co. (ISBN 0-88415-859-4)
- (en) GA Burdock (2005). Fenaroli's Handbook Of Flavor Ingredients. Fifth Edition. CRC Press. (ISBN 0849330343) p1880-1881
- (en) GA Burdock (2005). Fenaroli's Handbook Of Flavor Ingredients. Fifth Edition. CRC Press. (ISBN 0849330343) p639-640
- (en) C. Maugans et C. Ellis, « Wet Air Oxidation: A Review of Commercial Sub-Critical Hydrothermal Treatment », dans Twenty First Annual International Conference on Incineration and Thermal Treatment Technologies, 13-17 mai 2002 [texte intégral (page consultée le 12 septembre 2011)]
Liens externes
- (en) Electronic Plant Information Centre at Royal Botanic Gardens, Kew 2003-11-8
- (en) La cristallisation de la vanilline
- (en) Compound Display 1183 NCBI database
- (en) COMPOUND: C00755 www.Genome.net
- Portail de la chimie
- Portail de l’alimentation et de la gastronomie
- Portail des odeurs, des senteurs et du parfum
Catégories :- Arôme
- Benzaldéhyde
- Hydroxyméthoxybenzène
- Vanille
Wikimedia Foundation. 2010.