- Oxyde d'hydrogène
-
Molécule d'eau
 Pour les articles homonymes, voir eau (homonymie).Article principal : eau.
Pour les articles homonymes, voir eau (homonymie).Article principal : eau.Eau 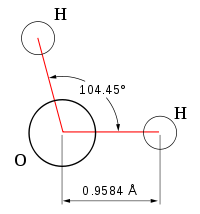
Géométrie de la molécule d’eau et représentation 3D Général No CAS No EINECS SMILES InChI Apparence liquide transparent, et presque sans couleur avec une légère touche de bleu[1] Propriétés chimiques Formule brute H2O [Isomères] Masse molaire 18,0153 g∙mol-1
H 11,19 %, O 88,81 %,Propriétés physiques T° fusion 0 °C T° ébullition 100 °C Masse volumique 1,00 g∙cm-3 (liquide à 4 °C)
0,917 g∙cm-3 (solide)Viscosité dynamique 0,001 Pa·s à 20 °C Point critique 370 °C, 220 bar[2] Point triple 0,01 °C à 611,73 Pa Conductivité thermique 565 mW⋅K-1⋅m-1 Tension superficielle à 20 °C 7,28 N/m Conductivité électrique 5,5×10-6 S⋅m-1 Thermochimie ΔfH0gaz -241,5 kJ⋅mol-1 ΔfH0liquide -285,8 kJ⋅mol-1 ΔfH0solide N/A ΔfusH° 335 kJ⋅kg-1 ΔvapH° 2 257,92 kJ⋅kg-1 Cp 1 850 J⋅kg-1⋅K-1 (gaz)
4 186 J⋅kg-1⋅K-1 (liquide)
2 060 J⋅kg-1⋅K-1 (solide)Cv 3 724 J⋅kg-1⋅K-1 (gaz) Unités du SI & CNTP, sauf indication contraire. La molécule d’eau[3], de formule H2O, est le constituant essentiel de l’eau pure. Celle-ci contient également des ions résultant de l’autoprotolyse de l’eau selon l’équation d’équilibre : H2O = H+ + OH- (ou encore 2H2O = H3O+ + OH-). L’eau pure n’est pas présente naturellement dans la nature et doit être obtenue par des processus physiques.
Cette molécule a des propriétés complexes à cause de sa polarisation (voir le paragraphe Nature dipolaire de l’eau).
L’eau à pression ambiante (environ un bar) est gazeuse au-dessus de 100 °C, solide en dessous de 0 °C, et principalement liquide entre les deux. C’est là une particularité essentielle : les autres composés proches ou apparentés (sulfure d’hydrogène, ammoniac et méthane) sont tous gazeux même à des températures bien plus basses.
Les chimistes se réfèrent parfois (avec humour) à l’eau avec un nom savant (et justifié) comme du monoxyde de dihydrogène dans des parodies de recherche scientifique sérieuse qui présentent ce produit comme mortellement dangereux et à bannir.
Sommaire
Physique
Propriétés générales
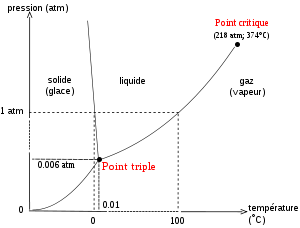 Diagramme de phase de l’eau, montrant l’état de l’eau pure en fonction de la température et de la pression.
Diagramme de phase de l’eau, montrant l’état de l’eau pure en fonction de la température et de la pression.
L’état solide de l’eau est la glace ; l’état gazeux est la vapeur d'eau. L’état de l’eau dépend des conditions de pression P et de température T. Il existe une situation unique (P,T) dans laquelle l’eau coexiste sous les trois formes solide, liquide, et gazeux ; cette situation est appelée « point triple de l’eau », elle a lieu à une température de 273,16 K (0,01 °C) et une pression de 611,2 Pa.
Les unités de température (degrés Celsius, kelvin) sont définies en prenant ce point triple de l’eau comme référence.
La vélocité du son dans l’eau est de 1 500 m⋅s-1 dans les conditions normales de température et de pression.
La conductivité électrique de l'eau pure à 20°C est très faible : 5,5×10-6 S⋅m-1. L'eau pure est donc considérée comme un isolant électrique.
La masse d’un litre d’eau à la température de 4 °C était la première définition du kilogramme. Par approximation, on prend pour masse volumique de l’eau dans les conditions normales la valeur de 1 000 kg⋅m-3, une tonne par mètre cube ou encore un kilogramme par litre (1 kg⋅L-1).
La chaleur massique de l’eau est de 4 186 J⋅kg-1⋅K-1 dans les conditions normales de température et de pression. L’eau était utilisée comme étalon de chaleur dans d’anciens systèmes d’unité : la calorie (et la frigorie) quantifiait la chaleur à apporter pour augmenter d’un degré Celsius la température d’un gramme d’eau : soit 4,185 joules.
L’eau est pratiquement considérée comme un fluide incompressible dans la plupart des applications. Son coefficient de compressibilité est de 4,5×10-10 Pa-1
Tableau 1 : Quelques propriétés de l’eau en fonction de la température Temp. (°C) Masse volumique (g/cm3) Chaleur massique (J/g·K) Viscosité (µPa·s) Pression saturante (bar) Enthalpie de vaporisation (kJ/kg) 0 0,99984 4,2176 1793 0,00611 2500,5 10 0,99970 4,1921 1307 0,01228 2467,9 20 0,99821 4,1818 1002 0,02338 2453,4 30 0,99565 4,1784 797,7 0,04245 2429,6 40 0,99222 4,1785 653,2 0,07382 2405,9 50 0,98803 4,1806 547,0 0,12346 2309,9 60 0,98320 4,1843 466,5 0,19936 2357,7 70 0,97778 4,1895 404,0 0,31181 2333,1 80 0,97182 4,1963 354,4 0,47379 2308,2 90 0,96535 4,2050 314,5 0,70123 2282,7 100 0,95840 4,2159 281,8 1,01325 2256,6 Température d’ébullition de l’eau en fonction de l’altitude Altitude (m) Pression (Atm)[4] Temp. (°C) 0 1,00 100 4 810,9 (Mont Blanc) 0,54 85 8 844 (Everest) 0,32 72 19 200 0,063 37 À 20 000 m environ, l’eau entre en ébullition à la température du corps humain. C’est donc une barrière infranchissable pour l’homme sans dispositif de pressurisation (vêtement à pressurisation partielle, scaphandre, ou cabine pressurisée).
Propriétés liées à la vie terrestre
Certaines des caractéristiques de l’eau font d’elle une molécule remarquable, aux particularités qui ont permis à la vie sur Terre de se développer. Ces caractéristiques, surtout liées à sa nature dipolaire, sont explicitées dans les chapitres qui suivent.
- L’eau a une force de cohésion élevée, ce qui rend cette matière difficile à évaporer (température d’ébullition particulièrement élevée pour une molécule de cette masse molaire). Cela permet à une importante phase liquide d’exister aux températures connues sur Terre, phase liquide indispensable à la vie telle que nous la connaissons.
- De même, ses propriétés de solvant « doux » permettent à un très grand nombre de réactions biochimiques de se produire.
- Le fait que la densité de l’eau soit plus grande à l’état liquide que solide, propriété commune avec le Bismuth, a une conséquence remarquable : la glace flotte sur l’eau liquide. De surcroît, le fait que la densité de l’eau douce soit maximale à 4 °C fait que la température au fond d’un lac ne peut pas descendre en dessous de 4 °C (sauf cas extrêmes). Cela permet à la vie aquatique de survivre aux périodes glacées, car l’eau reste liquide sous son manteau de glace isolant (pour la plupart des espèces chimiques, la densité à l’état liquide est plus faible qu’à l’état solide).
- Par ailleurs, sa tension superficielle particulièrement élevée permet le phénomène de capillarité (qui permet, entre autres, à la sève des végétaux de monter) et à de nombreux êtres vivants de se déplacer sur la surface de l’eau.
Formes
- Voir la catégorie : Forme de l’eau
L’eau peut prendre beaucoup de formes. L’état solide est communément appelé glace (tandis que beaucoup d’autres formes existent ; voir l’eau amorphe) ; l’état gazeux est appelé vapeur d’eau (ou vapeur), et la phase liquide ordinaire est tout simplement appelée l’eau. Au-dessus d’une certaine température et pression critique (647 K et 22,064 MPa), les molécules d’eau entrent dans un état dit supercritique, dans lequel des agrégats moléculaires présentant des caractéristiques proches de l’eau liquide sont dans une phase de type gaz.
L’explication physique du fait que l’eau solide soit moins dense que l’eau liquide vient de la structure cristalline de la glace, connue sous le nom de glace Ih (h pour hexagonale). L’eau, le gallium, le bismuth, l’acide acétique, l’antimoine et le silicium sont quelques uns des matériaux qui prennent plus de place sous forme solide ; la plupart des autres matériaux se contractent. Il faut toutefois noter que toutes les formes de glace ne sont pas moins denses que l’eau liquide. Par exemple la glace HDA et la glace VHDA sont toutes les deux plus denses que l’eau liquide pure. Dans ce cas, la raison pour laquelle la forme commune de la glace est moins dense est un peu moins intuitive, elle dépend fortement des propriétés intrinsèques peu communes des liaisons hydrogène.
Indice de réfraction
Tableau 1
Indice de réfraction de l’eau en fonction
de sa température et de la
longueur d’onde de la lumièreLongueur d’onde
λ (nm)T = 10 °C T = 20 °C T = 30 °C 706,5 1,330 7 1,330 0 1,329 0 589,3 1,333 7 1,333 0 1,331 9 501,6 1,337 1 1,336 4 1,335 3 404,7 1,343 5 1,342 7 1,341 7
Tous les milieux transparents sont dispersifs, ce qui signifie que la vitesse de la lumière change avec sa longueur d’onde λ. Plus précisément, dans la partie visible du spectre électromagnétique (approximativement 400 à 700 nanomètres) l’indice de réfraction est généralement une fonction décroissante de la longueur d’onde : la lumière bleue est plus déviée que le rouge. En outre, le taux de changement de l’indice de réfraction augmente lorsque la longueur d’onde diminue. L’indice de réfraction augmente habituellement avec la densité du milieu.L’eau présente toutes ces caractéristiques.
Le tableau 1 montre les résultats de quelques mesures (Tilton et Tailor) de l’indice de réfraction de l’eau par rapport à de l’air sec de même température T que l’eau et à la pression de une atmosphère (760 mmHg ou 1 013 hPa).Pour convertir les valeurs sous forme de tableaux relatifs à l’indice du vide, ajouter 4 à la quatrième position décimale. Noter que l’indice de réfraction augmente lorsque la température de l’eau diminue. Ces résultats sont conformes aux attentes, puisque la densité de l’eau liquide augmente lorsqu’elle se refroidit. Cependant, si les mesures sont faites à de plus basses températures l’indice ne montre pas d’extremum à 4 °C, bien que la densité de l’eau y soit maximale.
L’indice de réfraction est également une fonction de la pression de l’eau, mais la dépendance est faible en raison de l’incompressibilité relative de l’eau (comme tous les liquides). En fait, sur les gammes normales des températures (0 à 30 °C), l’augmentation approximative de l’indice de réfraction est de 0,000016 quand la pression de l’eau augmente d’une atmosphère.
Les facteurs les plus significatifs affectant l’indice de réfraction sont la longueur d’onde de la lumière et la salinité de l’eau. Néanmoins, l’indice de réfraction excède de moins de 1 % la gamme indiquée des valeurs de ces variables.
- Références
- L. W. Tilton et J. K. Taylor, stand national de bureau de recherche de J., 20, 419 (RP1085) 1938.
- E. Dorsey, « propriétés d’Eau-Substance ordinaire », (Reinhold Publishing Corporation 1940).
Chimie
Nature dipolaire
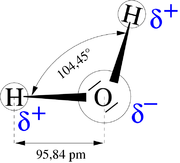
Une propriété très importante de l’eau est sa nature polaire. La molécule d’eau forme un angle de 104,45° au niveau de l’atome d’oxygène entre les deux liaisons avec les atomes d’hydrogène. Puisque l’oxygène a une électronégativité plus forte que l’hydrogène, l’atome d’oxygène a une charge partielle négative δ-, alors que les atomes d’hydrogène ont une charge partielle positive δ+. Une molécule avec une telle différence de charge est appelée un dipôle (molécule polaire). Ainsi, l’eau a un moment dipolaire de 1,83 D. Cette polarité fait que les molécules d’eau s’attirent les unes les autres, le côté positif de l’une attirant le côté négatif d’une autre. Un tel lien électrique entre deux molécules s’appelle une liaison hydrogène.
Cette polarisation permet aussi à la molécule d’eau de dissoudre les corps ioniques, en particulier les sels, en entourant chaque ion d’une coque de molécules d’eau par un phénomène de solvatation.
Cette force d’attraction, relativement faible par rapport aux liaisons chimiques covalentes de la molécule elle-même, explique certaines propriétés comme le point d’ébullition élevé (quantité d’énergie calorifique nécessaire pour briser les liaisons hydrogène), ainsi qu’une capacité calorifique élevée.
À cause des liaisons hydrogènes également, la densité de l’eau liquide est supérieure à la densité de la glace.
Autoprotolyse
L’eau se dissocie naturellement en ion oxonium H3O+ (aussi appelé hydronium) et ion hydroxyde OH− :
- 2 H2O = H3O+ + OH−
La réaction est dite d’autodissociation ou d’autoprotolyse.
Dans cette réaction, l’eau joue à la fois le rôle d’acide et de base : comme acide, elle perd un proton H+ et devient l’ion hydroxyde OH− ; comme base elle gagne un proton H+ et devient l’ion oxonium H3O+. On dit donc que c’est une espèce amphotère ou un ampholyte.
La constante d’équilibre de cette réaction est très faible (10-14 à 25 °C) ; le nombre d’ions oxonium et hydroxyde formés est donc très minoritaire devant le nombre de molécules d’eau.
Du fait de l’équilibre, à une température donnée, le produit des concentrations de ces ions est constant, égal à la constante de dissociation. À 25 °C, il vaut :- [H3O+].[OH−] = 10−14
Dans l’eau pure, les ions H3O+ et OH− sont issus uniquement de l’autoprotolyse de l’eau, ils sont donc présents en concentrations égales, donc :
- [H3O+] = [OH−] = 1×10−7 mol⋅L−1 (à 25 °C)
Le pH étant défini à partir de la concentration en ions oxonium (pH = −log10 [H3O+]), à 25 °C, le pH de l’eau pure vaut donc 7, il est dit neutre.
Cet équilibre acide/base est d’une importance capitale en chimie minérale comme en chimie organique.
Comme solvant
Grâce à sa polarité, l’eau est un excellent solvant. Quand un composé ionique ou polaire pénètre dans l’eau, il est entouré de molécules d’eau. La relative petite taille de ces molécules d’eau fait que plusieurs d’entre elles entourent la molécule de soluté. Les dipôles négatifs de l’eau attirent les régions positivement chargées du soluté, et vice versa pour les dipôles positifs. L’eau fait un excellent écran aux interactions électriques (la permittivité électrique εe de l’eau est de 78,5 à 25 °C), il dissocie donc facilement les ions.
En général, les substances ioniques et polaires comme les acides, alcools, et sels se dissolvent facilement dans l’eau, et les substances non-polaires comme les huiles et les graisses se dissolvent difficilement. Ces substances non-polaires restent ensemble dans l’eau car il est énergétiquement plus facile pour les molécules d’eau de former des liaison hydrogène entre elles que de s’engager dans des interactions de van der Waals avec les molécules non polaires.
Un exemple de soluté ionique est le sel de cuisine alias chlorure de sodium, NaCl, qui se sépare en cations Na+ et anions Cl−, chacun entouré de molécules d’eau. Les ions sont alors facilement transportés loin de leur matrice cristalline. Un exemple de soluté non ionique est le sucre de table. Les dipôles des molécules d’eau forment des liaisons hydrogène avec les régions dipolaire de la molécule de sucre.
Cette faculté de solvant de l’eau est vitale en biologie, parce que certaines réactions biochimiques n’ont lieu qu’en solution (par exemple, réactions dans le cytoplasme ou le sang.)
C’est pourquoi, pour le moment, l’eau liquide est considérée comme indispensable à la vie et est activement recherchée sur les divers astres du système solaire, notamment sur Mars et Europe, une lune de Jupiter.Tension superficielle
Les liaisons hydrogène confèrent à l’eau une grande tension superficielle et une grande cohésion. Cela se voit quand de petites quantités d’eau sont posées sur une surface non soluble et que l’eau reste ensemble sous forme de gouttes. Cette propriété qui se manifeste par la capillarité est utile dans le transport vertical de l’eau chez les végétaux et nuisible avec la remontée d’humidité dans les murs de maisons.
Conductivité
L’eau pure est un mauvais conducteur d’électricité. Mais puisque l’eau est un bon solvant, elle contient souvent une grande quantité de solutés dissouts, le plus souvent des ions. Si l’eau contient de telles impuretés, elle peut conduire l’électricité plus facilement. Le stator des très gros alternateurs est refroidi par circulation d’eau déionisée dans les conducteurs creux de l’enroulement. Malgré les différences de potentiel de plusieurs dizaines de milliers de volts entre le circuit de refroidissement et les conducteurs électriques, il n’y a pas de problèmes de fuite de courant. Voir conductivité électrique (mesure).
La pureté de l’eau peut être mesurée par sa résistance à un courant électrique.
Décomposition (thermolyse et électrolyse)
La première décomposition de l’eau fut faite par Lavoisier, en faisant passer de la vapeur d’eau sur du fer chauffé au rouge (thermolyse). Ce faisant, il établit que l’eau n’était pas un élément mais un corps chimique composé de plusieurs éléments.
La thermolyse de l’eau commence à devenir significative vers 750 °C et elle est totale vers 3 000 °C. La réaction produit du dioxygène et du dihydrogène :
- 2 H2O → 2 H2 + O2
L’autre manière de décomposer l’eau est l’électrolyse. Sous l’effet d’une tension appliquée entre deux électrodes plongées dans de l’eau, l’eau peut être décomposée en dihydrogène et dioxygène. Les molécules d’eau se dissocient naturellement en ions H3O+ et OH−, qui sont attirés par la cathode et l’anode respectivement mais comme cette dissociation est faible dans la pratique on a recours à des catalyseurs comme l’acide sulfurique ou l’hydroxyde de sodium. À l’anode, quatre ions OH− se combinent pour former des molécules de dioxygène O2, deux molécules d’eau, et libérer quatre électrons. Les molécules de dioxygène ainsi produites s’échappent sous forme de bulles de gaz vers la surface, où elles peuvent être collectées. Dans le même temps, à la cathode, il y a une libération de deux molécules de dihydrogène H2 avec utilisation de quatre électrons.
- 4OH− → O2 + 2H2O + 4e−
- 4H3O+ + 4e− → 2H2 + 4H2O
Production de l'eau pure
L’eau pure est un excellent solvant et absorbe facilement les gaz qui entrent à son contact. Par conséquent, l’eau pure est pratiquement introuvable. Les laboratoires d’analyses ont néanmoins besoin de cette eau pure pour réaliser des analyses fiables. Ils vont donc faire appel, au cours du temps, à des techniques de purification de plus en plus sophistiquées.
Après l’eau distillée, bidistillée, déminéralisée, déionisée, la technique progresse vers une eau de plus en plus pure, donc coûteuse à produire et de plus en plus instable.
Notes et références
- ↑ (en)Pourquoi l’eau est-elle bleue ?
- ↑ http://www.dotapea.com/gazliquidessolides.htm
- ↑ On pourrait également l’appeler oxyde de dihydrogène, hydroxyde d’hydrogène, acide hydroxyque, hydroxyde d’hydronium, ou acide hydrique, ou bien génériquement « oxyde d’hydrogène » ; mais de tels noms ne sont guère utilisés.
- ↑ De combien la pression diminue-t-elle avec l’altitude ?
Voir aussi
Articles connexes
- L’eau lourde est un composé formé d’un atome d’oxygène et de deux atomes de deutérium, qui est un isotope de l’hydrogène (« l’oxyde de deutérium », D2O).
- Solvant
- Solution
- Solution aqueuse
- Complexe
- Hydrogène
- Hydrate
- Liaison hydrogène
- Oxygène
- Glace
Liens externes
- (en) Water phase diagrams
- Portail de la chimie
- Portail de l’eau
Catégories : Eau | Solvant | Oxyde | Hydroxyde | Composé de l'hydrogène | Composé de l'oxygène
Wikimedia Foundation. 2010.