- Autoprotolyse
-
Une autoprotolyse est une réaction de transfert de proton entre deux molécules identiques, l'une jouant le rôle d'acide au sens de Bronsted et l'autre celui de base[1].
Sommaire
Écriture générale
L'autoprotolyse est une réaction de type acido-basique au cours de laquelle une espèce amphotère (on dit également ampholyte) réagit sur elle-même (d'où le préfixe auto-). Si on note cette espèce amphotère AH, alors
- AH se comporte comme un acide et libère un proton H+ :

- AH se comporte comme une base et capte un proton H+ :

L'équation chimique d'une autoprotolyse est donc de la forme générale :

Autoprotolyse de l'eau
L'eau se comporte comme un acide :

L'eau se comporte comme une base :

Les ions HO- et H3O+ ainsi formés sont immédiatement solvatés (hydratés).
On écrit donc :

Constante d'équilibre
La constante d'équilibre de cette réaction est appelée produit ionique de l'eau et notée Ke.
Ke=[H3O+(aq)]·[HO-(aq)]
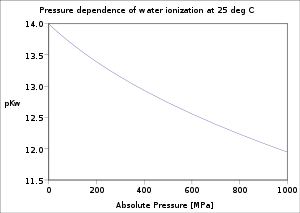
À 25 °C Ke vaut 10-14.
Pour l'eau pure, on en déduit [H3O+(aq)] = [HO-(aq)] = 10-7 mol·L-1, d'où son pH : pH = -log [H3O+(aq)] = 7. C'est pourquoi le pH de la neutralité est fixé à 7.
Autres espèces amphotères (ou ampholytes)
Autoprotolyse de l'ammoniac :

Autoprotolyse de l'ion hydrogénocarbonate:

Notes et références
- AH se comporte comme un acide et libère un proton H+ :
Wikimedia Foundation. 2010.