- Larves de moustiques
-
Culicidae

« Moustique » redirige ici. Pour les autres significations, voir Moustique (homonymie). Moustique

Aedes (Stegomyia) aegypti Classification classique Règne Animalia Sous-règne Metazoa Embranchement Arthropoda Sous-embr. Hexapoda Super-classe Protostomia Classe Insecta Sous-classe Pterygota Infra-classe Neoptera Super-ordre Endopterygota Ordre Diptera Sous-ordre Nematocera Infra-ordre Culicomorpha Famille Culicidae
Meigen, 1818
larves de moustique

D'autres documents multimédia
sont disponibles sur CommonsParcourez la biologie sur Wikipédia : Les Culicidae regroupent les insectes communément appelés moustiques ou maringouins[1] (au Québec). Classée dans l'ordre des Diptères et du sous-ordre des Nématocères, cette famille est caractérisée par des individus aux antennes longues et fines à multiples articles et par des femelles possédant de longues pièces buccales en forme de trompe rigide de type piqueur-suceur.
Les moustiques ont un rôle extrêmement important en santé humaine (ou animale) car ils constituent, de par les piqûres douloureuses qu’ils engendrent, et au-delà de ce statut d’insectes nuisants, le plus important groupe de vecteurs d’agents pathogènes transmissibles à l’homme. Les moustiques sont responsables, entre autres, du paludisme, une des toutes premières causes de mortalité humaine, de nombreuses maladies à virus (arboviroses) telles que la dengue, la fièvre jaune, la fièvre de la vallée du Rift, la fièvre du Nil occidental (West Nile Virus), le chikungunya, d’encéphalites virales diverses ainsi que de filarioses et constituent à ce titre l’un des sujets majeurs d’études en entomologie médicale.
A ce jour (Harbach,2009) 3 519 espèces de moustiques sont décrites, réparties en trois sous-familles (Toxorhynchitinae, Anophelinae et Culicinae) et plus de 44 genres.
Sommaire
Morphologie des divers stades de développement
Stade adulte
Au stade adulte, leur taille varie selon les genres et espèces de 3 à 40 mm mais elle ne dépasse que très rarement les 10 mm, à l'exception de la sous-famille des Toxorhynchitinae.
Les moustiques, au stade adulte, comme tous les Diptères, possèdent une seule paire d'ailes membraneuses longues et étroites pourvues d’écailles le long de ses nervures, repliées horizontalement au repos. La deuxième paire est réduite à une paire de balanciers.
Les Culicidae possèdent un corps mince et des pattes longues et fines. Ils se reconnaissent facilement par la présence d'écailles sur la majeure partie de leur corps.
Au niveau de la tête, ils se différencient des autres familles de Diptères Brachycères (exemple les mouches) par des antennes longues et fines à nombreux articles, dépourvues de style ou d'arista. Les femelles se distinguent facilement des mâles qui sont les seuls à présenter des antennes plumeuses. Les femelles possèdent de plus de longues pièces buccales caractéristiques de type piqueur-suceur : la trompe ou proboscis qui inflige la douloureuse piqûre si redoutée. Signalons que la tête des Culicidae est dépourvue d’ocelles.
Le thorax des moustiques présente un segment médian hypertrophié renfermant les muscles des ailes. Ce segment porte les ailes longues et étroites pourvues d’écailles qui peuvent être rares ou abondantes, larges ou étroites, claires ou sombres. La répartition des soies et des écailles sur le thorax revêt une grande importance dans la détermination des différents genres et espèces de Culicini. Citons : les soies acrosticales (sur le « dos » du thorax), les soies pré ou postspiraculaires (avant ou après le spiracle), les soies mésépimérales inférieures et supérieures.
L'abdomen des moustiques est formé de dix segments dont les deux derniers sont télescopés à l’intérieur du 8ème segment : ils sont modifiés en organes reproducteurs. Les premiers segments forment des anneaux emboîtés les uns dans les autres et réunis par une membrane flexible. La partie dorsale (tergite) et la partie ventrale (sternite) de chaque anneau sont réunies latéralement par des membranes souples qui permettent à l'abdomen de se dilater lors du repas de sang. Cette capacité assure également la respiration du moustique par les mouvements de dilatation et de contraction de grande amplitude de l'abdomen, permettant la circulation de l’air au niveau de ses spiracles. Chez les mâles, les 9ème et 10ème segments qui forment les génitalia ont une structure d'une assez grande variété. Leurs caractères morphologiques sont très utilisés pour la détermination de l'espèce.
Stade larvaire
Ce stade est aquatique. Les larves de Culicidae se différencient des autres insectes aquatiques par l'absence de pattes. Ces larves sont clairement constituées de trois parties :
- une tête pourvue d'une paire d'antennes, d'une paire de mandibules armées de dents sur leur bord distal et qui forment avec le mentum l'appareil masticateur, l'ensemble flanqué d’une paire de brosses buccales qui entraînent les aliments vers cet appareil ;
- un thorax plus large que la tête ;
- un abdomen pourvu au niveau du huitième segment d'un siphon respiratoire pour deux des trois sous-familles : Toxorhynchitinae et Culicinae. Les espèces de la sous-famille des Anophelinae en sont dépourvu, respirant directement à partir de papilles anales postérieures.
Stade nymphal
La nymphe présente un céphalothorax fortement renflé avec deux trompettes respiratoires. L'extrémité abdominale est aplatie en palettes ou nageoires. Au niveau du céphalothorax se distinguent les ébauches de divers organes : yeux, proboscis, pattes, ailes. La nymphe ne se nourrit pas mais, durant ce stade, le moustique subit de profondes transformations morphologiques et physiologiques préparant le stade adulte.
Taxonomie
En 1759, Carl von Linné désigne sous le genre Culex les quelques moustiques – et assimilés – connus de l'époque. Meigen, en 1888, redistribue ce genre en trois genres selon le critère morphologique de la longueur des palpes : genre Anopheles pour les moustiques à palpes longs pour les deux sexes, Culex avec les palpes longs pour les mâles et courts pour les femelles et Aedes aux palpes courts pour les deux sexes. Entre 1828 et 1896, au fil des nouvelles découvertes, les entomologistes Robineau-Desvoidy, Macquart, Lynch-Arribalzaga puis Williston apportent leur remaniement à la classification de ce qui deviendra la famille des Culicidae, créant les genres Megharinus (actuel Toxorhynchites), Psorophora, Sabethes, Ochlerotatus, Taeniorhynchus (actuel Mansonia), Ianthinosoma, Heteronycha, Uranotaenia et Hodgesia.
À la toute fin du XIXe siècle, le monde scientifique découvrit soudainement que les moustiques transmettaient de graves maladies telles que le paludisme (1880), les filarioses (1899) et la fièvre jaune (1900). Cette découverte provoqua la prospection intense de moustiques dans le monde entier, enrichissant les musées d'un abondant matériel et permettant une étude plus poussée de la taxonomie de ce groupe. Travaillant au British Museum de Londres, Frederick Vincent Theobald, dans son ouvrage en six volumes, A Monograph of the Culicidae of the World paru de 1901 à 1910, créa de nombreux genres pour déboucher sur une classification de la famille comprenant six sous-familles. Frederick Wallace Edwards, en 1932, inclut au rang de sous-famille les dixines et chaoborines dans la famille des Culicidae, les moustiques formant la sous-famille des Culicinae divisée en 3 tribus : Anophelini, Toxorhynchitini et Culicini, ces derniers divisés en 5 groupes : Sabethes, Uranotaenia, Theobaldia (actuel Culiseta), Aedes et Culex. Stone, en 1957, supprima les Dixinae et Chaoborinae des Culicidae et en 1959, Knight, Stone et Starke, dans leur ouvrage A synoptic Catalog of the Mosquitoes of the World (Diptera, Culicidae) reconnaissent 3 sous-familles : Anophelinae, Toxorhynchitinae et Culicinae, ceux-ci divisés en 2 tribus : les Culicini et les Sabethini. Belkin en 1962 réintègre Chaoborinae et Dixinae mais subdivise les Culicinae en 10 tribus. Knight et Stone, pour la réédition de leur catalogue en 1977, adoptent dans son ensemble la classification de Belkin en excluant toutefois Chaoboridae et Dixidae.
Durant ces dernières décennies, le nombre d’espèces et de sous-genres a considérablement augmenté, avec des remaniements taxonomiques à divers niveaux. Ainsi, Reinert, (2000) divisa, sur la base des génitalia mâles et femelles, le prolifique genre Aedes en deux genres : Aedes, conservant 23 sous-genres et le genre Ochlerotatus (anciennement sous-genre du genre Aedes) captant 21 sous-genres. Dernièrement, Reinert et al (2004) proposèrent de diviser la tribu des Aedini en 63 genres au lieu de 12 mais ils furent peu suivis.
En 1959, 2 462 espèces de moustiques étaient décrites et validées de par le monde, 3 209 espèces en 1992 pour un total actuel dépassant les 3 500 espèces réparties en 44 genres et 145 sous-genres (Harbach, 2007). La classification phylogénétique n'est toujours pas totalement définie. Si certaines tribus sont monophylétiques (Aedini, Culicini et Sabethini), la phylogénie de la plupart des tribus reste incertaine (Harbach & Kitching,1998 ; Harbach, 2007).
Liste des sous-familles, tribus, genres et sous-genres
- sous-famille Toxorhynchitinae
- genre Toxorhynchites Theobald, 1901 (4 sous-genres, 95 espèces)
- sous-genre Toxorhynchites (56 espèces : présent sur l'Ancien Monde)
- sous-genre Afrorhynchus (20 espèces : uniquement présent en région afrotropicale)
- sous-genre Ankylorhynchus (4 espèces : Nouveau Monde)
- sous-genre Lynchiella (16 espèces : Nouveau Monde)
- genre Toxorhynchites Theobald, 1901 (4 sous-genres, 95 espèces)
- sous-famille Anophelinae
- genre Anopheles Meigen, 1818 (7 sous-genres, 455 espèces : régions néotropicale, afrotropicale, asiatique)
- sous-genre Anopheles Meigen,1818 (188 espèces : région afrotropicale)
- sous-genre Cellia Theobald, 1902 (216 espèces : Ancien Monde)
- sous-genre Kerteszia Theobald, 1905 (12 espèces : région néotropicale)
- sous-genre Lophodomyia Antunes, 1937 (6 espèces : région néotropicale)
- sous-genre Nyssorhynchus Blanchard (28 espèces : région néotropicale)
- sous-genre Stethomyia Theobald (région néotropicale)
- genre Bironella Theobald , 1905 (3 sous-genres, 8 espèces : région australasienne)
- sous-genre Bironella Theobald, 1905 (2 espèces)
- sous-genre Brugella Edwards, 1930 (3 espèces)
- sous-genre Neobironella (3 espèces)
- genre Chagasia Cruz, 1906 (4 espèces : région néotropicale)
- genre Anopheles Meigen, 1818 (7 sous-genres, 455 espèces : régions néotropicale, afrotropicale, asiatique)
- sous-famille Culicinae Meigen, 1818 (39 genres, 3 035 espèces)
Du fait de leur abondance, les sous-genres ne sont pas cités pour cette sous-famille. Se reporter à la page de chaque genre.
- Tribu Aedeomyiini
- Aedeomyia Theobald, 1901 (2 sous-genres, 6 espèces : régions afrotropicale, néotropicale, orientale et australasienne)
- Tribu Aedini Neveu-Lemaire, 1902
- Aedes Meigen, 1818 (263 espèces, 23 sous-genres : cosmopolite)
- Armigeres Theobald, 1901 (2 sous-genres, 58 espèces : région orientale, australasienne)
- Ayurakitia Thurman, 1954 (2 espèces : région asiatique (Thaïlande))
- Borichinda Harbach & Rattanarithikul, 2007 (1 espèce : région orientale)
- Eretmapodites Theobald, 1901 (48 espèces : région afrotropicale exclusivement)
- Haemagogus Williston, 1896 (2 sous-genres, 28 espèces : région néotropicale principalement)
- Heizmannia Ludlow 1905 (2 sous-genres, 39 espèces : région orientale)
- Ochlerotatus Lynch Arribalzaga, 1891 (22 sous-genres, 550 espèces : cosmopolite)
- Opifex Hutton, 1902 (2 espèces : Nouvelle-Zélande)
- Psorophora Robineau-Desvoidy, 1827 (3 sous-genres, 48 espèces : Nouveau Monde)
- Udaya Thurman, 1954 (3 espèces : région orientale)
- Verrallina Theobald, 1903 (3 sous-genres, 95 espèces : région australasienne, orientale essentiellement)
- Zeugnomyia Leicester, 1908 (4 espèces : région orientale)
- Tribu Culicini Meigen, 1818
- Culex Linnaeus, 1758 (23 sous-genres, 763 espèces : cosmopolite)
- Deinocerites Theobald, 1901 (18 espèces : Nouveau Monde)
- Galindomyia Stone & Barreto, 1969 (1 espèce : région néotropicale (Colombie))
- Lutzia Theobald, 1903 (3 sous-genres, 7 espèces : cosmopolite, initialement sous-genre du genre Culex, ressuscité par Tanaka (2003) au rang de genre)
- Tribu Culisetini
- Culiseta Felt, 1904 (37 espèces : région néarctique, ancien monde)
- Tribu Ficalbiini
- Ficalbia Theobald, 1903 (8 espèces : régions afrotropicale (4 spp.), orientale (3spp.), australasienne)
- Mimomyia Theobald, 1903 Theobald (3 sous-genres, 42 espèces : régions afrotropicale, orientale, australasienne)
- Tribu Hodgesiini
- Hodgesia Theobald, 1904 (11 espèces : régions afrotropicale, orientale, australasienne)
- Tribu Mansoniini
- Coquillettidia Dyar, 1905 (66 espèces : région afrotropicale, néotropicale, australasienne)
- Mansonia Blanchard, 1901 (24 espèces : région afrotropicale, Ancien Monde)
- Tribu Orthopodomyiini
- Orthopodomyia Theobald, 1904 (38 espèces : cosmopolite, pas d'importance médicale - ne piquent pas l'homme-)
- Tribu Uranotaeniini
- Uranotaenia Lynch Arribalzaga, 1891 (2 sous-genres, 266 espèces : région afrotropicale, orientale, asiatique)
- Tribu Sabethini
- Isostomyia Coquillett, 1906 (4 espèces : région néotropicale)
- Johnbelkinia Zavortink, 1979 (3 espèces : région néotropicale)
- Limatus Theobald, 1901 (8 espèces : région néotropicale)
- Malaya Leicester, 1908 (12 espèces : régions afrotropicale, orientale, australasienne, ex genre "Harpagomyia")
- Maorigoeldia Edwards (une espèce : Nouvelle Zélande)
- Onirion Harbach & Peyton, 2000 (7 espèces : région néotropicale, issu du genre Wyeomyia Theobald)
- Runchomyia Theobald (7 espèces : région néotropicale)
- Sabethes Robineau-Desvoidy, 1827(5 sous-genres, 38 espèces : région néotropicale)
- Shannoniana Lane & Cerqueira (3 espèces : région néotropicale)
- Topomyia Leicester, 1908 (2 sous-genres, 58 espèces : région orientale, australasienne)
- Trichoprosopon Theobald, 1901 (13 espèces : région néotropicale)
- Tripteroides Giles (5 sous-genres, 122 espèces : régions orientale, australasienne)
- Wyeomyia Theobald (15 sous-genres, 140 espèces : région néotropicale principalement, Nouveau Monde)
Bioécologie des moustiques
Cycle de développement
L'accouplement a lieu peu de temps après l’émergence des adultes, chaque femelle étant fécondée une seule fois pour toute sa vie.
Avant l'accouplement, les mâles forment un essaim, peu après le coucher du soleil, à quelques mètres du sol. Ce phénomène est observable en Afrique pour An. garmbiae et An. funestus et il est probable qu'il existe également chez d'autres espèces.
Le repas de sang est alors indispensable à la ponte pour les espèces hématophages. Toutefois, les femelles peuvent parfaitement se gorger d'eau sucrée et de nectar et vivre longtemps, mais alors elles constituent des réserves adipeuses au lieu de pondre. Quarante-huit heures après la prise du repas de sang, les femelles fécondées déposent leurs œufs, selon les espèces : à la surface d'eaux stagnantes (mare, étang) ou courantes (torrent, bord de rivière), dans des réceptacles naturels (flaque, trou de rocher, aisselles de feuilles, trou d'arbres…) ou artificiels (pneu, gouttière, pot de fleurs, carcasse de voiture…) ou sur des terres inondables (marécage, rizière...). Ces œufs sont pondus soit isolément (Toxorhynchites, Aedes, Anopheles), soit en amas (Culex, Culiseta, Coquillettidia, Uranotaenia) ou bien fixés à un support végétal immergé (Mansonia). La fécondité totale d’une femelle varie selon les espèces de 800 à 2 500 œufs.
Ces œufs se développent en un à deux jours et éclosent, donnant naissance à des larves aquatiques de premier stade qui possèdent (à l’exception des Anopheles) au bout de l'abdomen un siphon respiratoire qui émerge à la surface de l'eau.
Les gîtes larvaires sont très diversifiés selon les genres et les espèces et comprennent les eaux courantes (torrent de montagne, rivière) ou stagnantes (étang, mare, rizière, marécage, bord de rivière, fossé, flaque), ensoleillées ou ombragées (en forêt), de grande dimension (lac, fleuve) ou de petite taille (feuille morte), à forte teneur en sels minéraux (eau de mer ou eau saumâtre) ou chargées de matières organiques, les gîtes naturels de type phytothelmes (aisselle de feuille, bambou fendu, trou d’arbre, urne de plante carnivore) ou autres (trou de crabe, coquille d’escargot, trou de rocher) ou artificiels (citerne, latrine, rejet d’égout, abreuvoir, pneu, carcasse de voiture, boîte de conserve, pot de fleur…).
Les larves s'alimentent et se maintiennent au repos sous la surface de l’eau, respirant par leurs spiracles qui affleurent à la surface et situés soit au niveau du 8e segment abdominal pour les Anopheles (qui doivent donc pour respirer se maintenir parallèle à la surface de l’eau), soit à l’extrémité du siphon respiratoire pour les Toxorhynchitinae et les Culicinae (qui doivent donc maintenir leur corps oblique par rapport à la surface pour respirer). Enfin, certains genres de Culicinae ont leurs larves immergées, respirant par l'intermédiaire de la tige d'un végétal dans lequel elle insère son siphon (Coquillettidia, Mansonia, quelques espèces du genre Mymomyia).
Les larves passent par quatre stades de développement et se métamorphosent en une nymphe. Ce stade ne se nourrit pas.
La nymphe, qui est également libre, présente un céphalothorax fortement renflé avec deux trompettes respiratoires. L'extrémité abdominale de la nymphe est aplatie en palettes ou nageoires.
De la nymphe émergera au bout de deux jours l'adulte volant.
La plupart des espèces ont une activité nocturne (genre Culex, Anopheles, Mansonia ) ou bien essentiellement diurne (Toxorhynchites, Tripteroides) à crépusculaire (genre Aedes). En région afrotropicale, la majorité des moustiques se nourrissent la nuit ou au crépuscule, au moins en zone de savanes et à basse altitude ; en montagne où il fait très froid la nuit et en forêt dense où règne en permanence une mi-obscurité, un certain nombre d'espèces ailleurs nocturnes ou crépusculaires attaquent couramment de jour. Chaque espèce de moustique semble posséder, dans des conditions climatologiques déterminées, un cycle d'activité qui lui est propre. Chez le genre Anopheles, la durée du stade larvaire est d'environ sept jours (si les conditions extérieures sont favorables : qualité de l'eau, température et nourriture essentiellement). Les adultes vivent selon les conditions et les espèces de 15 à 30 jours.
Dans les zones tempérées, à l'arrivée de l'hiver, certains moustiques cherchent un endroit pour hiverner, et s'ils n'en trouvent pas (ce qui arrive fréquemment), ils meurent, laissant leurs larves perpétuer seules l'espèce à l'arrivée du printemps.
Alimentation
Les adultes mâles et femelles se nourrissent de nectar de fleurs, et participent ainsi à la pollinisation des plantes, au même titre que les papillons, par exemple.
De plus, les femelles (à l'exception des espèces du genre Toxorhynchites), afin d'assurer le développement de leurs œufs, ont recours à des repas de sang sur des vertébrés divers à sang chaud (oiseaux, mammifères dont l'homme) ou à sang froid comme les batraciens (grenouille, crapaud), les reptiles (serpent, tortue) ou d'autres insectes (larves de Lépidoptères, nymphes de cicadelle, mantes). Traversant la peau jusqu'à un vaisseau, elle effectue une prise de sang. Chaque espèce a sa propre spécificité plus ou moins affirmée dans le choix de l'hôte pour ce repas de sang. On parle de moustique anthropophile s'il pique préférentiellement l'homme ou zoophile s'il pique préférentiellement les animaux.
Les larves de moustiques ont pour la plupart une alimentation constituée de phytoplancton, de bactérioplancton, d'algues microscopiques et de particules de matière organique en suspension dans l'eau du gîte. La larve s'alimente grâce aux battements de ses soies buccales qui créent un courant suffisant pour aspirer les aliments.
D'autres espèces sont prédatrices au stade larvaire, se nourrissant essentiellement de larves de Culicidae divers. Ce type de comportement alimentaire est assez rare parmi les Culicidae, ne se rencontrant que pour l'ensemble des espèces des genres Toxorhynchites, Psorophora et Lutzia, chez les Aedes du sous-genre Mucidus, les Tripteroides du sous-genre Rachisoura et chez des espèces des genres Sabethes, Eretmapodites et Culiseta.
Intérêt médical
Rôle vectoriel
Les Culicidae constituent le tout premier groupe d'insectes d'intérêt médical. Les moustiques sont vecteurs de trois groupes d'agents pathogènes pour l'homme : Plasmodium, filaires des genres Wuchereria et Brugia ainsi que de nombreux arbovirus. Plus de 150 espèces de Culicidae relevant de 14 genres ont été observées porteuses de virus impliqués dans des maladies humaines (Mattingly, 1971). C'est par sa trompe qui lui sert à piquer que le moustique transmet les pathogènes à l'homme ou aux animaux.
La trompe (proboscis) de la femelle est composée par des pièces buccales vulnérantes ou stylets (maxilles, labre, hypopharynx) qui sont enveloppées par le labium souple qui se replie au moment de la piqûre.
Le moustique enfonce les stylets dans l’épiderme jusqu’à un capillaire sanguin grâce aux maxilles qui perforent la peau et qui permettent à la trompe de se maintenir en place lors du prélèvement sanguin.
Les stylets délimitent deux canaux : l’un, formé par l’hypopharynx, par lequel est injectée une salive anesthésiante et anticoagulante, l’autre, au niveau du labre, par lequel est aspiré le sang qui, s’il est infecté, contamine le moustique. La quantité de sang prélevée varie de 4 à 10 millimètres cubes en 1 à 2 minutes.[2]
Mêlé au sang aspiré, le parasite pathogène -excepté les filaires- (Plasmodium spp. responsables du paludisme, le virus de la dengue, de la fièvre jaune, le virus du Nil occidental ou le virus du chikungunya…) parvient dans l'estomac du moustique, puis franchit la paroi stomacale. Une fois multiplié, il se retrouve dans les glandes salivaires du moustique qui l'inocule à son hôte lors de la piqûre, par la salive infectée, via l’hypopharynx.
Les genres Aedes, Culex, Eretmapodites, Mansonia et Anopheles contiennent la majorité des espèces qui s'attaquent à l'homme.
Paludisme
Article détaillé : Paludisme.Filarioses lymphatiques
Article détaillé : Filariose.Plus de 40 espèces de Culicidae, relevant de 4 genres, sont impliquées dans la transmission des filarioses lymphatiques. Ce sont des infections parasitaires engendrées par trois espèces de filaires : Wuchereria bancrofti, la plus fréquente et sa variété pacifica, Brugia malayi et Brugia timori.
La filariose de Bancroft à Wuchereria bancrofti sévit dans toute la zone intertropicale (Caraïbes, Amérique latine, Afrique, Inde, Asie du Sud-Est et les îles du Pacifique). La variété pacifica sévit en Océanie.
La filariose de Malaisie (ou filariose lymphatique orientale) due à Brugia malayi, est exclusivement asiatique (Asie du Sud-Est, Inde, Sri Lanka, Corée et Chine). Brugia timori ou filaire de Timor sévit dans les îles du Sud-Est de l'Indonésie (Timor).
Des moustiques des genres Culex (en particulier Culex quinquefasciatus), Anopheles et Aedes sont vecteurs des 2 types de filarioses.
En Afrique, W. bancrofti est transmis par Cx quinquefasciatus et, en Afrique centrale et occidentale, uniquement par des Anopheles : An. funestus, An. Complexe gambiae.
De plus, des espèces du genre Mansonia transmettent la filariose de Malaisie (Brugia malayi). Des espèces vivant dans des marécages ouverts (Mansonia uniformis, M. annulifera, M. indiana) sont vectrices de l’Inde jusqu’en Asie de l’est. Des espèces zoophiles et rurales, Mansonia bonneae, M. dives et M. uniformis sont vectrices en Thaïlande, Malaisie et aux Philippines. Des espèces Coquillettidia sont signalées vectrices en Indonésie.
Wuchereria bancrofti pacifica présente dans les îles du Pacifique sud est transmise majoritairement par Aedes (Stegomyia) polynesiensis, Ae. (Stegomyia) pseudoscutellaris, Ae. (Stegomyia) tongae, Ae. (Stegomyia) hebridea ainsi que par Ae. (Ochlerotatus) vigilax, espèce de Mangrove très agressive envers l’homme. Brugia timori est transmise par Anopheles barbirostris.
Le cycle est indirect et fait intervenir l'homme comme hôte définitif et un moustique comme hôte intermédiaire. Les microfilaires (larve de 1er stade) sont absorbées par le moustique lors d'un repas de sang chez un hôte infesté. Dans les 12 heures, elles traversent la paroi stomacale et gagnent la musculature thoracique du moustique. Là, après 2 mues, elles se transforment en une dizaine de jours en formes infectantes. Enfin, les larves de troisième stade migrent vers le labium et sont inoculées à l’hôte lors d’un nouveau repas de sang du moustique, pénétrant activement par la blessure créée par la piqure. Le parasite ne subit aucune multiplication chez le vecteur.
La forte présence de microfilaires au niveau des muscles thoraciques du Culicidae entraine chez ce dernier une diminution de sa capacité de vol.
Les filarioses lymphatiques touchent 120 millions de personnes dans 80 pays d'Afrique, d'Amérique latine et d'Asie et 40 millions d’entre elles souffrent de difformités et d'invalidités graves. Près d’un tiers des porteurs de la maladie vivent en Inde, un autre tiers en Afrique, tandis que le dernier tiers se répartit entre l’Asie du Sud-Est, le Pacifique occidental et l’Amérique latine.
Fièvre de la vallée du Rift
Article détaillé : Fièvre de la vallée du Rift.Fièvre jaune
Article détaillé : Fièvre jaune.Chikungunya
Article détaillé : Chikungunya.Virus du Nil occidental
Article détaillé : West Nile Virus.Dengue
Article détaillé : Dengue.Encéphalite de Saint Louis
Article détaillé : Encéphalite de Saint Louis.Cette encéphalite doit son nom à l'importante épidémie qui se déclara en 1933 dans la ville de Saint-Louis (États-Unis) au cours d'une sécheresse exceptionnelle. Ces conditions climatiques associées à une forte insalubrité favorisèrent le développement de Culex quinquefasciatus, moustique vecteur de cette encéphalite due à un arbovirus.
Encéphalite de la Murray Valley
Encéphalite japonaise
Les Culex, principalement Culex tritaeniorhynchus et dans une moindre mesure Culex annulus, Culex gelidus, Culex fuscocephala et le complexe Culex vishnui, sont les vecteurs de l'encéphalite japonaise. Ces espèces sont normalement zoophiles, mais s'attaquent à l'homme lors de fortes pullulations. Aedes japonicus est également cité comme espèce vectrice et peut transmettre le virus à sa descendance (transmission transovarienne) (Takashima & Rosen, 1989). Signalons également qu'une transmission verticale des virus des encéphalites japonaise et de St. Louis par Aedes albopictus est possible (Rosen, 1988).
Cette maladie virale (Flavivirus) est endémique dans le Sud-Est de l'Inde et au Sud-Est asiatique (Malaisie, Thaïlande, Vietnam, Philippines, Indonésie). Elle est épidémique en Chine (partie), en Corée ainsi que dans certaines régions d'Océanie, au nord de l'Australie et au Japon. L'encéphalite japonaise est une cause majeure d'encéphalite virale avec 30 000 à 50 000 cas cliniques signalés chaque année, provoquant 15 000 décès.
Les zones touchées sont essentiellement les zones rurales où les moustiques pullulent dans les rizières et zones inondées avec une forte activité crépusculaire et nocturne, infligeant alors à l'homme et aux animaux domestiques des piqûres douloureuses. L'homme n'est qu'un hôte accidentel du virus, favorisé en cela par la création de rizières et de porcheries à proximité d'habitations humaines. Le réservoir de base du virus est constitué par les oiseaux Ardeidae (hérons et aigrettes) et des canards vivant dans les zones humides, et pour réservoir relais les animaux domestiques (porcs principalement). Les chevaux, les chauves-souris et les reptiles sont également cités comme hôtes.
Il n’y a pas de transmission inter-humaine. Il existe un vaccin efficace contre cette maladie.
Nuisance
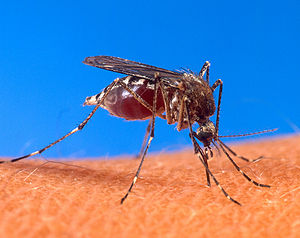 Le moustique Aedes (Stegomyia) aegypti lors d'une piqûre
Le moustique Aedes (Stegomyia) aegypti lors d'une piqûre
La femelle adulte, pour sa reproduction, pique les vertébrés pour prélever leur sang contenant des protéines nécessaires à la fabrication des œufs.
Tout comme la tique, le moustique repère sa cible grâce à son odorat : celui-ci leur révèle la présence de dioxyde de carbone et celle d'acides gras comme l'acide butyrique, aux relents ammoniaqués, émis par la respiration de la peau (c'est ce facteur qui fait que certaines personnes sont plus souvent piquées que d'autres). Des scientifiques américains ont identifié plus de 340 odeurs émises par la peau humaine susceptibles d'attirer les moustiques.
Pendant la piqûre, la femelle injecte de la salive anticoagulante (sur la photo ci-contre, un moustique femelle du genre Aedes, dont l'estomac est gorgé de sang) qui chez l'Homme provoque une réaction inflammatoire plus ou moins importante selon les individus : c'est la formation d'un « bouton » qui démange.
Les différentes espèces de moustiques ne s'attaquent pas aux mêmes cibles. Ainsi, Culex hortensis, Culex impudicus piquent de préférence les batraciens, Cusileta longiareolata les oiseaux alors qu'Aedes caspius et Culex pipiens préfèrent l’Homme.
Traitement des piqûres
Les piqûres peuvent être totalement indolores ou provoquer un prurit très désagréable ou des allergies plus graves, allant exceptionnellement jusqu'au choc anaphylactique. L’hypersensibilité a une origine immunitaire, qui traduit une réaction extrême de nos anticorps à des antigènes présents dans la salive du moustique.
Certains de ces antigènes sensibilisants existent chez tous les moustiques, tandis que d'autres sont spécifiques à certaines espèces. La réaction d'hypersensibilité peut être immédiate (types I et III) ou retardée (type IV) (Clements, 2000).
Divers remèdes sont plus ou moins efficaces selon les personnes et les délais d'application. Outre le vinaigre au peroxyde de zinc dont l'effet calmant n'est pas médicalement prouvé, des produits interdits en raison de leur toxicité, quelques médicaments existent ; antihistaminiques oraux ou topiques appliqués et diphenhydramine (Benadryl en onguent) qui semblent soulager efficacement les démangeaisons. Les corticostéroïdes topiques tels que l'hydrocortisone et la triamcinolone peuvent soulager, dans le cas de piqûres inopportunément placées.
On a cité l'application directe d'un tissu imbibé d'eau très chaude mais non bouillante pour bloquer (pour quelques heures) le dégagement d'histamine autour de la piqûre. L'application d'un Mylanta ou d'un antiacide liquide serait selon certains auteurs efficace en soulageant le prurit et le gonflement car réduisant l'acidité des anticoagulants injectés avec la salive de l'insecte.
Contrôle des moustiques
Limiter la prolifération des moustiques
Une bonne technique pour éviter d'être envahi par les moustiques à la maison est de leur fournir un/des nids pour leur ponte que l'on pourra contrôler et de supprimer tous les autres.
Pour cela, récoltez de l'eau de pluie dans un récipient assez large et profond (par exemple une brouette, une glacière…) et laissez-le au soleil si possible.
Les femelles seront ravies de trouver un tel volume d'eau et y pondront sans modération. Lorsque les larves commencent à être assez grosses, videz l'eau dans la terre en faisant bien attention qu'elle soit complètement absorbée.
Attention :
- Ne jamais vider l'eau dans une canalisation (égout, caniveau, etc.), car les larves resteraient en vie et donneraient naissance aux moustiques que vous essayiez d'éliminer.
- Vider l'eau un peu avant la date estimée d'éclosion des larves. Si vous avez un doute sur cette date, il vaut mieux vider l'eau de suite (le but est de limiter la reproduction des moustiques et non d'en faire un élevage).
- Prévenir les voisins et les inciter (ou les aider) à détruire, chez eux aussi, les petites collections d'eau sans prédateurs.
Dans les endroits tropicaux, il est aussi possible de favoriser le développement des grenouilles qui se nourrissent des larves de moustiques.
Limiter les risques de piqûre
De nombreuses méthodes sont réputées pour éviter d'être piqué par les moustiques, dont certaines sont inefficaces, peu efficaces ou sans efficacité prouvée. Pour se prémunir des piqûres dans les régions infestées, il faut combiner les moyens de protection et parfois de lutte.
La toile moustiquaire
La méthode de lutte donnant le meilleur résultat, notamment contre le paludisme, est l'utilisation de toile de gaze, appelée moustiquaire, éventuellement imprégnées d'insecticide ou de répulsif.
En 1983, au Burkina Faso, une première association insecticide-moustiquaire fut mis en place par imprégnation de moustiquaires dans la ville de Bobo-Dioulasso. Ces moustiquaires se sont avérée particulièrement efficaces contre les anophèles en termes de mortalité des moustiques et de réduction du taux de piqûres. Globalement, la moustiquaire imprégnée réduit de 36 pour cent le taux de piqûres des moustiques par rapport à une moustiquaire non traitée et tue de l’ordre de 37 pour cent des moustiques présents. Des campagnes de distribution gratuite de moustiquaires durablement imprégnées sont mises en œuvre dans plusieurs pays africains. Elles permettent de généraliser l’emploi des moustiquaires imprégnées, ce qui pourrait réduire de moitié environ l'impact du paludisme et de 20 pour cent la mortalité infantile [3].
Il existe aussi de la toile moustiquaire pour équiper les portes et les fenêtres, protéger le visage ou entourer une voiture d'enfant.
Vêtement adaptés
Une précaution de base consiste à se couvrir le corps aux époques, lieux et heures où sortent les moustiques femelles, avec des vêtements longs (manches longues, col roulé, pantalon, chaussettes). Les vêtements doivent être amples pour qu'elles ne puissent pas piquer à travers et de préférence sombres[4].
On trouve aussi dans le commerce des filets permettant de protéger la tête, fermés autour du cou par un élastique.Méthodes répulsives
La femelle moustique est attirée par une température entre 15° et 30°, l'humidité due à la transpiration ainsi que les différentes odeurs ou le CO2 émis par l'hôte à piquer[4]. Éviter de mettre des parfums et recourir à des répulsifs insectifuges adaptés[4]. Dans les zones infestées, la peau, mais aussi les vêtements, peuvent être imprégnés d'un répulsif à insecte (en évitant les yeux et les muqueuses). Le traitement est à renouveler tous les deux lavages pour les tissus.
Le répulsif le plus efficace est le DEET (N,N-diéthyl-3-méthylbenzamide, auparavant appelé N,N-diéthyl-m-toluamide), mais il est contre-indiqué pour les enfants[5]. Les répulsifs à base d'huile de haricot de soja et d'IR3535 (éthyl butylacétylaminopropionate) présentent une protection de plus courte durée. Les autres répulsifs d'origine végétale, dont l'essence de citronnelle, ont une durée d'effet très courte et sont donc considérés comme inefficaces. Les bracelets dits « antimoustiques » n'ont montré aucune efficacité[6]. Les répulsifs à base de la molécule icaridine sont particulièrement actifs contre les moustiques vecteurs de maladie.
Selon certains récits de vie à l'écart de la civilisation que la salive mélangée à du tabac puisse être efficace. La nicotine est effectivement un excellent insecticide naturel. Le feu et la fumée éloigneraient aussi les moustiques, mais non sans conséquences pour la santé des humains qui respirent cette fumée.
Une légende entretenue par des fabricants de gadgets prétend que les moustiques mâles émettraient une vibration ultrasonique inaudible pour l'oreille humaine mais répulsive pour les femelles en gestation, période pendant laquelle elles piquent. Les appareils du type « stop-moustiques électronique », censés éloigner les moustiques par émission d'ultrasons, sont en réalité inefficaces[4] [7], la femelle étant insensible à ces vibrations.
L'élimination des moustiques dans les lieux clos
Des diffuseurs d'insecticide existent, mais ne présentent d'intérêt que dans une pièce fermée, en apportant alors d'autres risques avérés ou potentiels pour la santé, des enfants notamment[réf. souhaitée].
Les électrocuteurs d'insectes n'ont pas d'efficacité sur les moustiques[4]. Certains vendeurs proposent des lampes anti-moustiques, constituées d'une lampe émettant une lumière blanche, bleue ou ultraviolette attirant les insectes, et entourée d'une grille alimentée en haute tension. Le tout est évidemment protégé par une grille en isolant (plastique), pour des raisons de sécurité[8]. Cependant, les moustiques étant attirés par l'odeur des mammifères et en aucun cas par la lumière[9], ce genre de dispositif tuera tous les insectes nocturnes de passage sauf les moustiques.
Pour l'élimination des moustiques, citons une méthode manuelle efficace à 100% en lieu clos : utiliser l'aspirateur électrique pour les moustiques posés sur une surface[réf. nécessaire] (vérifier que l'air expulsé ne va pas en direction des moustiques).
Bio-indicateur
Une distinction essentielle concerne la manière dont pondent les différentes espèces. Certaines (genre Aedes) pondent leurs œufs sur des zones humides temporaires, donc dans des secteurs susceptibles de se mettre en eau et de s'assécher au gré des conditions climatiques. Leurs œufs peuvent survivre à la dessiccation. D'autres espèces (genres Culex, une partie des Anopheles) pondent leurs œufs à la surface des eaux stagnantes.
Pour les Aedes, la prolifération en très grand nombre est due à des événements climatiques importants (fortes précipitations après une longue période de sécheresse). Il y a alors apparition concomitante d'une très grande quantité de larves aquatiques, due à la submersion d'une grande quantité d'œufs. Quelques jours plus tard, les adultes (imago) vont apparaître.
Ceci est un phénomène naturel qui n'a rien à voir avec une action anthropique. Dans ce cas, le moustique ne peut être considéré que comme un bio-indicateur. De même, pour les autres espèces appartenant aux genres précités, même si parfois leur nombre augmente avec la teneur en matière organique, il est toujours délicat de les utiliser comme bio-indicateurs. C'est pour cela qu'ils ne figurent jamais dans les différents indices biotiques existants (IBGN par exemple) établis pour les rivières, peu colonisées par les moustiques.
Évolution
Les moustiques sont apparus au Jurassique, il y a environ 170 millions d'années. Le fossile le plus ancien date du Crétacé. Ils ont évolué sur ce qui correspond aujourd'hui à l'Amérique du Sud avant de s'étendre d'abord vers la Laurasie au nord avant de redescendre vers les tropiques.
Les moustiques préhistoriques étaient environ trois fois plus gros que les espèces actuelles et étaient un groupe voisin des Chaoboridae (moucherons piquants).
Moustiques et aquariophilie
Les larves de moustique sont utilisées comme nourriture en aquariophilie, et sont commercialisés sous trois formes : lyophilisées, congelées ou vivantes.
Vivantes, elles sont appréciées par les poissons prédateurs : cichlidés, combattants, gouramis…
Il est facile de se procurer des larves de moustique en laissant croupir de l'eau dans un récipient (l'ajout d'herbe coupée ou d'une branche peut accélérer le processus). Après quelques semaines, vous pourrez récolter avec une épuisette pour aquarium une multitude de larves.
Notes et références
- ↑ Terme emprunté au tupi-guarani. Entrée « Maringouin » dans le Grand dictionnaire terminologique, OQLF.
- ↑ http://www.vn.refer.org/science-action/article.php3?id_article=2
- ↑ (Hougard, 2008)
- ↑ a , b , c , d et e Dr Tennstedt, "Peaux et moustiques". Dans Progrès en dermato-allegologie - Lille 2004. Groupe d'études et de recherches en dermato-allergologie (Lire en ligne page pp 91-104)
- ↑ On a recensé dans le monde 12 cas de convulsions chez l'enfant depuis la mise en œuvre de ce produit, sans que l'origine de ces convulsions puisse être imputée au produit ; il s'agit donc là d'un principe de précaution que certains jugent abusif.
- ↑ Mark S. Fradin, M.D. et John F. Day, “Comparative Efficacy of Insect Repellents against Mosquito Bites”, New England Journal of Medicine, volume 347 : 13-18 July 4, 2002, n° 1
- ↑ Enayati AA, Hemingway J, Garner P., “Electronic mosquito repellents for preventing mosquito bites and malaria infection”, Cochrane Database Syst Rev., 2007 18; CD005434
- ↑ À noter qu'une charge résiduelle persiste longtemps après le débranchement
- ↑ vous n'en verrez jamais tourner autour d'une lampe la nuit
Bibliographie
- Systématique :
- Neveu-Lemaire M. (1923). L’évolution de la classification des Culicidae. Annales de Parasitologie. T. 1 (1). 18 pp.
- Harbach R. E. & Peyton E. L. (2000). Systematics of Onirion, a new. genus of Sabethini (Diptera: Culicidae) from the Neotropical region. Bull. nut. Hist. MUS. Lond. (Ent.) 69(2): 115-169. http://www.mosquitocatalog.org/pdfs/wr363.pdf
- Harbach R. E. (2007) The Culicidae (Diptera): a review of taxonomy, classification and phylogeny. Zootaxa 1668:591–638.
- Reinert, J.F. (2000). New classification for the composite genus Aedes (Diptera: Culicidae: Aedini), elevation of subgenus Ochlerotatus to generic rank, reclassification of the other subgenera, and notes on certain subgenera and species. Journal of the American Mosquito Control Association, 16, 175–188.
- Systématique et biologie :
- Lane R. & Crosskey. (1993). Medical insects and arachnids. The natural History Museum. London. 723 pp. (ISBN 0-412-40000-6).
- Rôle vecteur :
- Takashima I. & Rosen L. (1989). Horizontal and vertical transmission of Japanese encephalitis virus by Aedes japonicus (Diptera: Culicidae). Journal of medical entomology. Vol. 26 (5), pp.454-458. (ISSN 0022-2585).
- Rosen L. (1988). Further observations on the mechanism of vertical transmission of flaviviruses by Aedes mosquitoes. The American journal of tropical medicine and hygiene. Vol. 39, no1, pp. 123-126. (ISSN 0002-9637).
- Contre les piqûres de moustique :
- Mark S. Fradin, M.D. et John F. Day, “Comparative Efficacy of Insect Repellents against Mosquito Bites”, New England Journal of Medicine, volume 347 : 13-18, 4 juillet 2002, n° 1
- Yves SCIAMA, Moustiques, la grande menace, Sciences et Vie, juin 2006.
Voir aussi
Articles connexes
- Chironome et Tipule, deux types d'insectes Diptères pouvant être confondus avec les culicidae.
- Glossaire des insectes
Liens externes
- Référence Fauna Europaea : Culicidae (en)
- Référence ITIS : Culicidae (fr) ( (en))
- Référence Animal Diversity Web : Culicidae (en)
- Référence NCBI : Culicidae (en)
- Article sur les larves de moustique en aquariophilie (www.aquabase.org)
- Moustique, Faune et flore du pays
- Portail de la zoologie
Catégories : Culicidé | Nourriture en aquariophilie | Insecte vecteur
Wikimedia Foundation. 2010.


