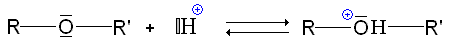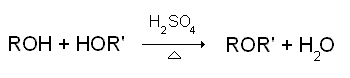- Alcoxy
-
Éther-oxyde
 Pour les articles homonymes, voir Éther.
Pour les articles homonymes, voir Éther.Les éther-oxydes, appelés aussi plus simplement éthers, sont des substances chimiques, de la forme R-O-R', où R et R' sont des chaînes carbonées. Ils sont souvent utilisés en chimie organique pour protéger des fonctions alcool lors de réactions de synthèse. Ils ont d'ailleurs avec ces derniers de nombreuses propriétés communes. (dues à la liaison C-O, et aux doublets libres de l'oxygène => voir géométrie).
Sommaire
Nomenclature
En ce qui concerne les éthers non cycliques : par rapport à l'oxygène central, la chaîne alkyle la plus longue est utilisée en suffixe et l'autre chaîne en préfixe de type alcoxy. Exemples : méthoxypropane (CH3-O-C3H7), éthoxyéthane (C2H5-O-C2H5)...
Pour ce qui est des éthers cycliques, on utilise le nom qu'aurait un alcane cyclique si l'on remplaçait l'oxygène de l'éther par un carbone, et on rajoute le préfixe "oxa". Par exemple, pour un éther cyclique avec 3 atomes de carbone et 1 atome d'oxygène : oxacyclobutane. Pour un éther cyclique avec 5 atomes de carbone et 1 atome d'oxygène : oxacyclohexane...
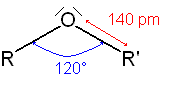
Géométrie
Dans le cadre de la théorie VSEPR, nous avons une molécule de type AX2E2: géométrie tétraédrique, molécule coudée. L'angle R-O-R' est de l'ordre de 120°, la longueur de la liaison C-O, proche de 140 pm (en théorie 143).
Caractéristiques
États
Dans les conditions ordinaires, les éthers sont, pour la plupart, des liquides assez volatils. Les températures d'ébullition, sont assez proches de celles des alcanes et très inférieures à celles des alcools (=>pas de liaison hydrogène possible entre les éthers) correspondants.
Solubilité
Très grande solubilité dans l'eau pour les éthers ayant des chaînes carbonées courtes (4 atomes de carbone, très faible au-delà de 12 atomes de carbone) : en effet, même s'il n'y a pas de liaison hydrogène possible entre deux molécules d'éthers, elles peuvent exister entre l'oxygène de l'éther et les atomes d'hydrogène de l'eau. Du fait de leur miscibilité avec beaucoup de produits organiques, ils sont souvent employés comme solvants.
Polarité
Les éther-oxydes sont des molécules polaires (à cause des doublets localisés sur l'oxygène).
Spectroscopie infrarouge
Vibration C-O-C (asym) C-O-C (sym) Nombre d'onde(cm-1) 1260-1070 1055-870 Intensité (forte) (forte) Réactivité
Cette molécule présente donc 2 liaisons simples carbone-oxygène et 2 doublets libres sur l'oxygène.
- Les doublets donnent aux éther-oxydes des propriétés de base de Brönsted, indifférente dans l'eau (pKA de l'ordre de 3.5):
mais aussi de base de Lewis.
Ils donnent aussi a l'éther-oxyde des propriétés nucléophiles.
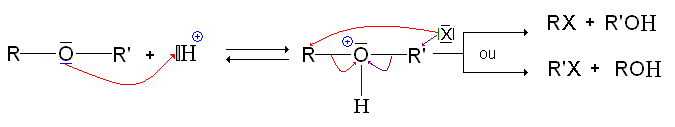
- La liaison C-O étant polarisée, elle est prédisposée à une rupture ionique. Cependant, RO- étant un très mauvais groupe partant (encore pire que HO-, dans le cadre des alcool, il fait des éther-oxydes des molécules relativement inertes. Cette propriété est utilisé d'ailleurs pour protéger les fonctions alcools.
Il peut y avoir rupture de la liaison C-O, en présence d'halogénure d'hydrogène (principalement iodure) :
Différents exemples
Éthers non cycliques
Éther (di)éthylique
Également appelé oxyde de diéthyle ou éthoxyéthane : CH3 — CH2 — O — CH2 — CH3 ou C4H10O.
Dans le langage courant, on le désigne souvent sous le terme d'éther (ou éther sulfurique ou éther éthylique. Il a été utilisée en médecine pour ses propriétés antiseptiques et anesthésiques et sa capacité à dissoudre les colles (résidus de pansements adhésifs).
Aujourd'hui, il est remplacé pour l'anesthésie humaine par des substances plus fiables et sert principalement de solvant organique courant, servant aussi à extraire le tetrahydrocannabinol des plantes de cannabis sativa.
La première synthèse aurait été réalisée par Valerius Cordus en 1540.
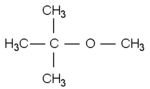
2-méthoxy-2-méthylpropane (MTBE)
Le MTBE (de sa dénomination anglo-saxonne méthyltertiobutyléther) est utilisé pour augmenter l'indice d'octane des carburants. Son utilisation est remise en cause du fait de sa toxicité quand il se retrouve dilué dans l'eau de boisson, par suite de fuites notamment.
Éthers cycliques
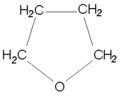
Époxydes
Les époxydes ou oxacyclopropanes sont des éthers cycliques à trois chaînons. Ce sont des composés utilisés en chimie organique du fait de leur bonne réactivité.
Tétrahydrofurane
le tétrahydrofurane (THF)
 , éther cyclique à 5 chaînons, est un solvant incorporé dans les résines, colles et vernis. Il est utilisé en chimie comme réactif d'extraction.
, éther cyclique à 5 chaînons, est un solvant incorporé dans les résines, colles et vernis. Il est utilisé en chimie comme réactif d'extraction.
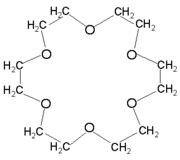
Éthers-couronne
 Représentation tridimentionelle
Représentation tridimentionelle
Les éthers-couronnes sont une famille chimique de création récente qui, avec les cryptands, a valu le Prix Nobel de chimie en 1987 à Charles J. Pedersen, Donald J. Cram et Jean-Marie Lehn.
Les plus simples ont 4, 5 ou 6 oxygènes reliés par des ponts alkyles. Leur cavité centrale permet de pièger des cations tels que Na+, Li+, K+, NH4+ par recouvrement orbitalaire avec les doublets non-liants des atomes d'oxygènes.
Des éthers-couronnes plus complexes sont produits avec 8 ... 30 atomes d'oxygène.
Ce sont des composés dont la toxicité reste à vérifier.
Éthers de glycols
Les éthers de glycols sont les dérivés de l'éthylène glycol (éthers de type E : R-O-(CH2-CH2)n-O-R') ou du propylène glycol (éthers de type P : R-O-[CH2-CH(CH2)]n-O-R', isomère alpha). Ce sont des liquides incolores et volatils qui dégagent une odeur agréable.
Ils se dissolvent dans l'eau et dans les graisses (amphiphiles) et passent de ce fait facilement à travers la peau.
Ils sont beaucoup utilisés comme solvant : vernis, peinture, colles, détergents, traitements anti-corrosion, fluides de coupe, dégraissant, mais aussi dans des produits domestiques (nettoyants pour vitres), cosmétiques ou pharmaceutiques.
Les éthers de glycol présentent une toxicité qui est en général faible (pas d'effets immédiats), mais se constate plutôt sur le long terme pour des personnes manipulant de grandes quantités (notamment ouvriers des usines). Plusieurs éthers de glycol sont interdits d'importation dans l'Union européenne. Parmi les effets toxiques, on trouve :
- troubles de la fertilité
- cytopénies sanguines, généralement réversibles, qui disparaissent à l'arrêt de l'exposition
- génotoxie : certains éthers pénètrent dans les cellules et en modifient le génome.
Synthèses
Synthèse de Williamson
La synthèse de Williamson consiste à produire des éther-oxydes par substitution nucléophile d'un halogénoalcane par un ion alcoolate.
L'équation générique de la réaction est :
On génère l'ion alcoolate à partir d'un alcool grâce par exemple à un métal réducteur (Na, K) ou encore de l'ion hydrure |H-. Les ions alcoolates ne peuvent exister dans l'eau, on utilise alors souvent comme solvant de l'alcool correspondant à l'alcoolate. On peut utiliser aussi d'autres solvants polaires, comme le DMSO (diméthylsulfoxyde) ou le DMF (N,N-diméthylformamide).
La synthèse de Williamson est quasiment limitée aux halogénoalcanes primaires (on obtient d'ailleurs un très bon rendement avec eux); en effet pour les halogénoalcanes secondaires ou tertiaires, la réaction concurrente d'élimination (on est en présence de base forte) est très importante. On obtient avec eux un rendement allant du médiocre au très mauvais. On peut faire des synthèses de Williamson intermoléculaires ou intramoléculaires (formation d'éthers cycliques).
Le mécanisme de cette réaction est celui d'une SN2 :
Alcoolyse d'un dérivé halogéné
Il est possible de transformer un dérivé halogéné tertiaire ou secondaire en éther-oxyde par alcoolyse. Il suffit de faire réagir un alcool sur un dérivé halogéné. Le mécanisme est alors celui d'une SN1
Synthèse par déshydratation d'un alcool
Le chauffage (modéré) d'un alcool en présence d'un acide fort (généralement l'acide sulfurique) provoque la déshydratation de l'alcool, avec formation d'un éther-oxyde. Il s'agit d'une déshydratation intermoléculaire d'équation:
Le THF (cf. ci-dessus) est ainsi synthétisé généralement grâce au butan-1,4-diol mis en présence de l'acide sulfurique.
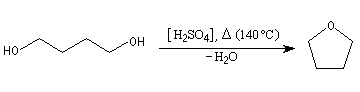
Annexes
Articles connexes
- Éther, pour les autres sens du mot
- André Cicolella, chercheur français qui a travaillé notamment sur les effets des éthers de glycol sur la santé
- Chélation
Liens externes
- (fr) Toxicité des éthers de glycol
- (fr) L'Institut national de recherche et de sécurité, (taper « éther » dans la boîte de recherche)
- (fr) Ethers-de-glycol.com
- (en) Rapport du CEH sur les éthers de glycol (payant)
- Portail de la chimie
Catégories : Éther | Groupe fonctionnel
Wikimedia Foundation. 2010.