- Acrylonitrile
-
Acrylonitrile 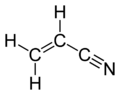
Général Nom IUPAC 2-propènenitrile Synonymes cyanure de vinyle
cyanure vinylique
nitrile acryliqueNo CAS No EINECS PubChem ChEBI SMILES InChI Apparence liquide incolore ou jaune pâle, d'odeur âcre[1]. Propriétés chimiques Formule brute C3H3N [Isomères] Masse molaire[4] 53,0626 ± 0,0028 g·mol-1
C 67,91 %, H 5,7 %, N 26,4 %,Moment dipolaire 3,92 ± 0,07 D [2] Diamètre moléculaire 0,468 nm [3] Propriétés physiques T° fusion -84 °C[1] T° ébullition 77 °C[1] Solubilité 70 g·l-1 à 20 °C Masse volumique 0,8 g·cm-3[1] T° d'auto-inflammation 481 °C[1] Point d’éclair -1 °C (coupelle fermée)[1] Limites d’explosivité dans l’air 3,05–17,0 % vol[1] Pression de vapeur saturante à 20 °C : 11,0 kPa[1] Point critique 45,6 bar, 262,85 °C [5] Thermochimie Cp Propriétés électroniques 1re énergie d'ionisation 10,91 ± 0,01 eV (gaz)[7] Propriétés optiques Indice de réfraction  1,388 [3]
1,388 [3]Précautions Directive 67/548/EEC[9] 
T
F
NPhrases R : 11, 23/24/25, 37/38, 41, 43, 45, 51/53, Phrases S : 9, 16, 45, 53, 61, Transport[9] 336 1093 NFPA 704 SIMDUT[10] 


SGH[9] 




DangerClassification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[8] Écotoxicologie LogP 0,25[1] Seuil de l’odorat bas : 1,6 ppm
haut : 22 ppm[11]Unités du SI & CNTP, sauf indication contraire. L' acrylonitrile est un nitrile de formule semi-développée CH2CHCN. C'est un liquide hautement inflammable d'odeur âcre. Il est un monomère utilisé dans la polymérisation de nombreuses fibres textiles (Orlon, Crylor® fabriquée par Rhône-Poulenc). En copolymérisation avec le butadiène, il fournit des élastomères « azotés » doués de propriétés remarquables, telles que la résistance aux huiles et aux agents chimiques, et avec le butadiène et le styrène, il forme des résines solides de hautes performances (résines ABS).
Production et synthèse
La principale synthèse industrielle est l'ammoxydation du propène via le procédé Sohio et ce depuis 1950 environ[12]:
Un mélange d'air, de propène et d'ammoniaque dans des proportions stoechiométriques est introduit dans un réacteur à lit fluidisé opérant de 400 à 500 °C et entre 30-200 kPa[12]. Un catalyseur est utilisé pour obtenir un réaction complète et sélective (les seules impuretés sont l'acide cyanhydrique et l'acétonitrile). Originellement à base de bismuth et de phosphomolybdate, les catalyseurs actuels sont formés d'antimoine et d'uranium ou de ferrobismuth et phosphomolybdate[12].
Précédemment, la production se faisait à base d'acétylène:
La réatcion avait lieu dans une solution diluée d'acide chlorhydrique en pésence de chlorure de cuivre(I). Les réactifs étant relativement chers et certaines impuretés tel le divinylacétylène posaient problème lors de la purification, ce procédé n'a pas résisté à la concurrence du procédé Sohio[12].
Utilisation
L'acrylonitrile CH2 = CH - CN est le monomère précurseur de polymères de synthèse comme le polyacrylonitrile, les fibres acryliques, le nylon, le caoutchouc synthétique.
Il est utilisé dans la fabrication de l'acrylonitrile butadiène styrène (ABS), dérivé important des polymères acryliques très utilisé dans les véhicules qui nécessitent un faible poids et une résistance élevée aux chocs. Ce matériau est un copolymère d’acrylonitrile, de butadiène et de styrène, d’où son nom d'ABS.L'hydrolyse de l'acrylonitrile conduit en outre à l'acide acrylique dont les esters sont les monomères de la synthèse des résines acryliques.
Voir article connexe sur la toxicité de ce produit : http://www.ledevoir.ca/2009/02/06/231895.html
¹ : Toxicité du produit, voir : http://www.ec.gc.ca/planp2-p2plan/default.asp?lang=Fr&n=28D7A173-1
² :Fiche documentaire concernant le Lot 2 du plan de gestion des produits chimiques du gouvernement du Canada, le 16 mai 2008; voir: http://www.ec.gc.ca/default.asp?lang=Fr&xml=942CD830-FD7D-4947-908A-458BB9DAB5F1
Notes et références
- ACRYLONITRILE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- Entrée de « Acrylonitrile » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 juillet 2011 (JavaScript nécessaire)
- « Acrylonitrile » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- Acrylonitrile sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- (en) Patrick W. Langvardt, Acrylonitrile, Wiley-VCH Verlag GmbH & Co, coll. « Ullmann's Encyclopedia of Industrial Chemistry », 15 juin 2000 [présentation en ligne]
Wikimedia Foundation. 2010.








