- Chlorure de cuivre(I)
-
Chlorure de cuivre(I) 
Général Synonymes Chlorure cuivreux No CAS No EINECS PubChem Apparence poudre blanche d'aspect verdâtre dû à la présence de traces de chlorure cuivrique Propriétés chimiques Formule brute ClCu
CuClMasse molaire[1] 98,999 ± 0,005 g·mol-1
Cl 35,81 %, Cu 64,19 %,Propriétés physiques T° fusion 426 °C (703 K) T° ébullition 1 490 °C (1760 K) (décomp.) Solubilité 0,062 g·l-1 d'eau (20 °C) Masse volumique 4,145 g·cm-3 Point d’éclair inflammable Cristallographie Structure type wurtzite[2] Propriétés optiques Indice de réfraction 1.930 [3] Précautions Directive 67/548/EEC 
Xn
NPhrases R : 22, 50/53, Phrases S : 2, 22, 60, 61, NFPA 704 Écotoxicologie DL50 140 mg·kg-1 Unités du SI & CNTP, sauf indication contraire. Le chlorure de cuivre(I), communément appelé chlorure cuivreux est le plus bas chlorure du cuivre avec la formule CuCl. Ce solide incolore est un précurseur versatile de nombreux autres composés du cuivre dont certains d'une importance commerciale. Il apparaît naturellement dans le minerai rare, la nantokite (en). Contrairement aux autres halogénures de métaux de transition de la première ligne, il forme des complexes stables avec le monoxyde de carbone (CO). Il cristallise dans un motif diamantoïde (en) qui reflète la tendance du cuivre(I) de former des complexes tétrahédriques.
Sommaire
Propriétés
CuCl est plus facilement disponible et moins toxique que d'autres acides de Lewis doux. De plus, le cuivre présente de nombreux degrés d'oxydation tels que I, II et III. La combinaison de ces propriétés définit certains des usages du chlorure cuivreux. C'est un acide de Lewis doux. Ainsi, il tend à former des complexes stables avec des bases de Lewis douces comme la triphénylphosphine:
- CuCl + P(C6H5)3 → [CuCl(P(C6H5)3)]4
bien que CuCl soit insoluble dans l'eau, il se dissous dans des solutions aqueuses contenant des molécules donneuses adéquates. Il forme des complexes avec les ions halogénures, par exemple H3O+ CuCl2- dans l'acide chlorhydrique concentré. Il se dissous aussi dans des solutions contenant des cyanures (CN-) ou des thiosulfates (S2O32-) ou de l'ammoniac (NH3) et forme alors des complexes.
Cependant, ses solutions aqueuses sont instable vis-à-vis de la dismutation en cuivre et chlorure de cuivre (II) (CuCl2)[4]. Ceci explique en particulier la couleur verdâtre des échantillons comme le montre la photo dans la chimiebox.
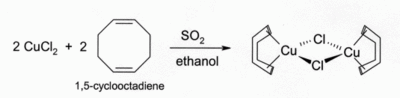
Ses solutions dans l'acide chlorhydrique ou ammoniacales absorbent le monoxyde de carbone pour former des complexes incolores comme le dimère à pont chlorure, [CuCl(CO)]2. Les mêmes solutions dans l'acide chlorhydrique peuvent réagir avec l'éthyne (HC≡CH) pour former [CuCl(C2H2)] tandis que les solutions ammoniacales forme de l'éthylénure de cuivre (I) , explosif. Les complexes de CuCl avec des alcènes peuvent être préparés par réduction du chlorure de cuivre (II) (CuCl2) avec le dioxyde de soufre (SO2) en solution alcoolique et en présence d'alcènes. Les complexes avec des diènes comme le 1,5-cyclooctadiène sont particulièrement stables[5]:
Utilisations
La principale utilisation du chlorure de cuivre(I) est qu'il est un précurseur de l'oxychlorure de cuivre (en), un fongicide. Pour cela, le chlorure de cuivre (I) est obtenu par codismutation et oxydation par l'oxygène de l'air:
- Cu + CuCl2 → 2 CuCl
- 6 CuCl + 3/2 O2 + 3 H2O → 2 Cu3Cl2(OH)4 + CuCl2
L'affinité de CuCl pour le monoxyde de carbone est exploité dans le procédé COPureSM.
En synthèse organique
Le chlorure de cuivre(I) catalyse une grande variété de réactions organiques.
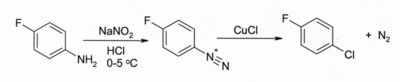
Dans la réaction de Sandmeyer (en), le traitement d'un sel d'arènediazonium (en) avec CuCl produit un chlorure d'aryle[6], par exemple :
Cette réaction a une large gamme d'emploi et donne habituellement de bons rendements.
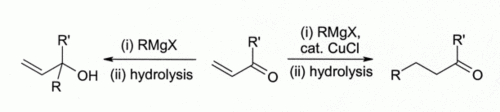
D'anciens chercheurs ont observés que le chlorure de cuivre(I) catalyse l'addition-1,4 d'organo-magnésiens sur les cétones α,β-insaturées[7] ce qui mena au développement des réactifs organocuivreux (en) qui ont, aujourd'hui, un très large emploi en synthèse organique[8]:
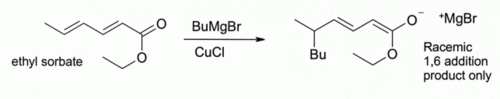
Par exemple, CuCl régit avec le méthyllithium(CH3Li) pour former un réactif de Gilman (en), (CH3)2CuLi qui a de très nombreux emplois en synthèse organique. Les organomagnésiens réagissent de la même façon. Cependant, même si d'autres composés du cuivre(I) comme l'iodure de cuivre(I) (en) sont maintenant préférés pour ce type de réaction, Le chlorure de cuivre (I) est encore recommandé dans certains cas[9], comme :
Ici, Bu correspond au groupe butyle. Sans CuCl, l'organo-magnésien seul donne un mélange des produits additionnés en 1,2- et 1,4- i.e. le butyle s'additionne sur l'atome de carbone le plus près du carbonyle C=O.
En chimie des polymères
Le chlorure de cuivre (I) est aussi un intermédiaire issu du chlorure de cuivre(II) dans le procédé Wacker (en). CuCl est utilisé comme catalyseur dans la polymérisation radicalaire par transfert d'atomes (ATRP).
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Copper(I) chloride » (voir la liste des auteurs)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Bodie E. Douglas, Shih-Ming Ho, Structure and Chemistry of Crystalline Solids, Pittsburgh, PA, USA, Springer Science + Business Media, Inc., 2006, 346 p. (ISBN 978-0-387-26147-8) (LCCN 2005927929)
- Pradyot Patnaik, Handbook of Inorganic Chemicals, McGraw-Hill, 2002. (ISBN 0070494398).
- Greenwood, N.N.; Earnshaw, A. Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Nicholls, D. Compleses and First-Row Transition Elements, Macmillan Press, London, 1973.
- (a) Wade, L. G. Organic Chemistry, 5th ed., p. 871, Prentice Hall, Upper Saddle RIver, New Jersey, 2003. (b) March, J. Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- Kharasch, M. S, « Factors Determining the Course and Mechanisms of Grignard Reactions. II. The Effect of Metallic Compounds on the Reaction between Isophorone and Methylmagnesium Bromide », dans J. Am. Chem. Soc., vol. 63, 1941, p. 2308 [lien DOI]
- asrzebski, J. T. B. H.; van Koten, G. in Modern Organocopper Chemistry, (N. Krause, ed.), p. 1, Wiley-VCH, Weinheim, Germany, 2002.
- (a) Bertz, S. H.; Fairchild, E. H. in Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, (R. M. Coates, S. E. Denmark, eds.), pp. 220-3, Wiley, New York, 1999. (b) Munch-Petersen, J., et al., Acta Chem. Scand., 15, 277 (1961).
Catégories :- Composé du cuivre
- Produit chimique nocif
- Produit chimique dangereux pour l'environnement
- Chlorure
Wikimedia Foundation. 2010.