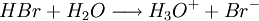Acide Bromhydrique
- Acide Bromhydrique
-
Acide bromhydrique
- Cet article concerne le bromure d'hydrogène en solution. Pour des informations concernant le gaz bromure d'hydrogène, voir l'article bromure d'hydrogène.
| Acide bromhydrique |
 |
| Modèle moléculaire du bromure d'hydrogène |
| Général |
| Nom IUPAC |
Acide bromhydrique |
| No CAS |
10035-10-6 |
| No EINECS |
233-113-0 |
| PubChem |
260 |
| SMILES |
|
| InChI |
|
| Apparence |
Liquide incolore |
| Propriétés chimiques |
| Formule brute |
HBr [Isomères]
H3O+ + Br- |
| Masse molaire |
80,912 g∙mol-1
H 1,25 %, Br 98,75 %,
|
| pKa |
-8 |
| Précautions |
|
Directive 67/548/EEC
|

C
|
|
Classification :
C; R35 - Xi; R37
Symboles :
C : Corrosif
Phrases R :
R34 : Provoque des brûlures.
R37 : Irritant pour les voies respiratoires.
Phrases S :
S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’ eau et consulter un spécialiste.
S45 : En cas d’ accident ou de malaise, consulter immédiatement un médecin ( si possible, lui montrer l’ étiquette).
S1/2 : Conserver sous clef et hors de portée des enfants.
S7/9 : Conserver le récipient bien fermé et dans un endroit bien ventilé.
|
| Phrases R : 34, 37, |
| Phrases S : 1/2, 7/9, 26, 45, |
|
NFPA 704
|
|
|
| Écotoxicologie |
| DL50 |
76 mg/g (rat, intrapéritonéale)[1] |
|
Unités du SI & CNTP, sauf indication contraire.
|
L’acide bromhydrique est une solution aqueuse contenant des ions bromures et des ions hydroniums. L'acide bromhydrique est formé par dissolution de bromure d'hydrogène HBr dans de l'eau et peut donc être utilisée pour préparer des sels de brome : les bromures.
Acidité
L'acide bromhydrique est un acide fort, plus fort que l'acide chlorhydrique mais plus faible que l'acide iodhydrique ainsi que l'acide perchlorique. Il est totalement dissocié dans l'eau. La molécule HBr se dissocie (s'ionise) pour donner un ion H+ (un proton). L'autre ion formé lors de la dissociation est l'ion bromure Br-. En solution aqueuse, l'ion H+ se lie à une molécule d'eau pour former un ion hydronium H3O+.
-
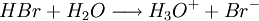
Le pKa du couple HBr (aq)/Br- vaut -8.
Réactivité
L'acide bromhydrique, sous l'action d'un grand nombre d'oxydants est transformé en dibrome et en eau. L'ion bromure est un réducteur et participe à des réactions d'oxydo-réduction. L'attaque du zinc dans une solution d'acide bromhydrique est plus rapide que celle du plomb, du cuivre et de l'argent.
Notes et références
Voir aussi
Liens externes
 Portail de la chimie
Portail de la chimie
Catégories : Composé du brome | Produit chimique corrosif | Acide halohydrique
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article Acide Bromhydrique de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
Acide bromhydrique — ● Acide bromhydrique acide HBr, résultant de la combinaison du brome avec l hydrogène. (Très soluble dans l eau, ce gaz incolore donne un acide fort qui agit sur la plupart des métaux et des bases pour donner des bromures.) … Encyclopédie Universelle
Acide bromhydrique — Cet article concerne le bromure d hydrogène en solution. Pour des informations concernant le gaz bromure d hydrogène, voir l article bromure d hydrogène. Acide bromhydrique Général Nom IUPAC Acide bromhydrique No CAS … Wikipédia en Français
bromhydrique — [ brɔmidrik ] adj. • 1845; de 2. brome et hydrique ♦ Chim. Acide bromhydrique, produit par la combinaison de l hydrogène et du brome, acide fort qui agit sur les métaux. ● bromhydrique adjectif Acide bromhydrique, acide HBr, résultant de la… … Encyclopédie Universelle
Acide Fort — Un acide fort est un acide qui se dissocie totalement dans l eau. Sommaire 1 Définition 2 Utilisations des acides forts 3 Exemples d acides forts 4 Sécurité … Wikipédia en Français
Acide Fluorhydrique — Général Nom IUPAC Acide fluorhydrique … Wikipédia en Français
Acide fluorhydrique — Général Nom IUPAC Acide fluorhydrique No CAS … Wikipédia en Français
Acide Conjugué — En chimie, l acide conjugué d une base est l espèce chimique (ion ou molécule) qui forme avec cette base un couple acide/base. L acide conjugué d une base forte est un acide très faible ou nul (les couple hydroxyde/eau, hydrure/hydrogène et… … Wikipédia en Français
Acide conjugue — Acide conjugué En chimie, l acide conjugué d une base est l espèce chimique (ion ou molécule) qui forme avec cette base un couple acide/base. L acide conjugué d une base forte est un acide très faible ou nul (les couple hydroxyde/eau,… … Wikipédia en Français
Acide Halohydrique — On appelle acides halohydriques des acides constitués d un cation hydrogène (H+) et d un anion halogénure (fluorure F , chlorure Cl , bromure Br , iodure I , , ...) Acide halohydrique … Wikipédia en Français
Acide halohydrique — On appelle acides halohydriques des acides constitués d un cation hydrogène (H+) et d un anion halogénure (fluorure F , chlorure Cl , bromure Br , iodure I , , ...) Acide halohydrique … Wikipédia en Français