- 7782-42-5
-
Graphite
Graphite 
Graphite Général Synonymes C.I. 77265
C.I. Pigment Black 10
Mine de plomb
PlombagineNo CAS No EINECS Apparence flocons noirs, blocs, poudre ou copeaux.[1] Propriétés physiques T° fusion Point de sublimation : 3 652 °C[1] Solubilité dans l'eau : insoluble[1] Masse volumique (eau = 1) : 2.09-2.23[1] Précautions SIMDUT[2] 
Unités du SI & CNTP, sauf indication contraire. 
Cet article est lié aux
composés du fer et du carbonePhases - Austénite
- Bainite
- Carbure de fer
- Cémentite
- Ferrite
- Graphite
- Lédéburite
- Martensite
- Perlite
Acier Autre produits ferreux Le graphite est un minéral qui est, avec le diamant, la lonsdaleite et la chaoite, l'un des allotropes naturels du carbone ; c'est un élément natif qui se trouve surtout dans les sédiments de métamorphisme régional mais, selon les roches, il peut se former aussi à partir du charbon organique, du magma ou par réduction des carbonates.
Sa structure est constituée de feuillets hexagonaux non compacts, nommés graphènes, séparés d'environ 0,336 nm le long de la direction de leur normale. Dans chaque feuillet, les atomes de carbone sont fortement liés par des liaisons covalentes de type sp2, tandis que les liaisons entre les feuillets sont faibles, de type π, ce qui explique le clivage et la faible dureté.
Sommaire
Origine du nom
Le chimiste suédois Carl Wilhelm Scheele a découvert seulement à la fin du XVIIIe siècle que ce minerai ne contenait pas de plomb, mais était une forme cristalline particulière du carbone ; on l'appelait à l'époque plombagine et on l'utilisait pour écrire.
C'est le géologue allemand Abraham Gottlieb Werner qui a inventé le terme « graphite », s'inspirant du grec γράφειν (graphein = écrire).
Propriétés physiques
Le graphite est la forme stable du carbone à température et à pression ordinaires.
L'apparence du graphite est celle d'un solide noir à l'éclat submétallique ; sa dureté est faible, entre 1 et 2 sur l'échelle de Mohs.
À cause de sa structure en feuillets, toutes les propriétés physiques du graphite sont anisotropes. En particulier, la conductivité électrique est très différente dans le plan des feuillets et dans la direction perpendiculaire.
Polytypisme
Le graphite existe en deux polytypes :
- graphite-2H, système cristallin hexagonal, classe cristalline dihexagonale-bipyramidale, groupe d'espace P 63/mmc, empilement de type ABAB où le plan B est translaté de
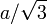 par rapport au plan A. Bien que sa structure soit analogue à celle des métaux qui cristallisent avec empilement hexagonal compact, le graphite est un non-métal. Il possède une certaine conductivité électrique, sa résistivité électrique est de 50 µΩ.m, soit 2900 fois celle du cuivre.
par rapport au plan A. Bien que sa structure soit analogue à celle des métaux qui cristallisent avec empilement hexagonal compact, le graphite est un non-métal. Il possède une certaine conductivité électrique, sa résistivité électrique est de 50 µΩ.m, soit 2900 fois celle du cuivre. - graphite-3R, trigonal à réseau rhomboédrique, empilement de type ABCABC. La structure rhomboédrique est instable : elle se produit par moulage et disparaît lors d'un recuit. On ne la trouve jamais comme forme pure, mais seulement comme tendance à l’empilement ABC dans les cristaux hexagonaux primaires.
Le charbon existe dans tous les états intermédiaires entre charbon amorphe et graphite hexagonal. On parle de graphite « lubricostratique » (latin « lubrico » rendre glissant) quand les couches sont déplacées parallèlement au hasard, et de graphite « turbostratique » (latin « turbo » tourbillon) si elles sont aussi tournées au hasard.
Utilisations
Le graphite a de nombreuses applications industrielles, sous diverses formes naturelles ou synthétiques :
- construction mécanique : pièces de frottement, joints d'étanchéité, produits lubrifiants ;
- construction électrique : balais de moteurs ;
- comme réducteur, notamment en sidérurgie (coke des hauts-fourneaux) ;
- comme électrode, par exemple en sidérurgie (acier électrique) ;
- comme cathode, par exemple dans l'industrie d'électrolyse de l'aluminium ;
- comme modérateur dans des réacteurs nucléaires ;
- comme adsorbant, dans les filtres à « charbon actif ».
Il est également utilisé en médecine comme absorbant en cas d'intoxication par voie orale.
Dans les arts plastiques, il est utilisé pour le dessin. Il sert en particulier à fabriquer des crayons, souvent sous l'appellation incorrecte de « mine de plomb ».
L'utilisation domestique la plus courante est le crayon à papier.
Aussi peut-il être utilisé comme composite d'alliage (Titane / Fibre de verre / Aluminium) dans la fabrication des cadres de raquettes de tennis.
Une forme pyrolytique du graphite est utilisée dans la fabrication de grilles pour les tétrodes de très grande puissance dans le domaine de la radiodiffusion. On peut citer par exemple la tétrode TH539 qui a été utilisée jusqu'en mars 2003 sur l'un des deux blocs émetteurs ondes longues d'Allouis de 1 000 kW.
Références
- ↑ a , b , c et d GRAPHITE (NATUREL), fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Graphite naturel » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Portail des minéraux et roches
- Portail de la chimie
Catégories : Carbone | Élément natif | Lubrifiant | Polymorphisme
Wikimedia Foundation. 2010.


