- C5H8NNaO4
-
Glutamate monosodique
Glutamate monosodique 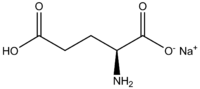
Général Nom IUPAC (2S)-2-amino-5-hydroxy-5-oxo
-pentanoate de sodiumSynonymes Sel sodique de l'acide glutamique
Sel de glutamateNo CAS (L(+) anhydre)
(L(+) monohydrate)No EINECS PubChem No E E621 FEMA Apparence Poudre blanche cristalline Propriétés chimiques Formule brute C5H8NNaO4 [Isomères] Masse molaire 169,1111 g∙mol-1
C 35,51 %, H 4,77 %, N 8,28 %, Na 13,59 %, O 37,84 %,
187,13 g/mol (monohydrate)Propriétés physiques T° fusion 235 °C Solubilité Très soluble dans l'eau. Unités du SI & CNTP, sauf indication contraire. Le glutamate monosodique (E621), communément nommé glutamate ou encore GMS, est utilisé principalement comme exhausteur de goût dans l'alimentation.
Sommaire
Histoire
Il a été découvert en 1908 par le professeur japonais Kikunae Ikeda de la compagnie Ajinomoto au Japon, à partir d'algue fucus.
Son procédé de fabrication a été breveté la même année. La production en 2003 est de plus de 1,5 million de tonnes dont 80 % seraient consommés en Asie. On évalue à 95 000 tonnes la consommation en Europe.
Son code dans le système harmonisé de l'organisation mondiale des douanes est le 29224220.
Structure et propriétés
La dénomination du glutamate monosodique dans la nomenclature de l'Union internationale de chimie pure et appliquée (IUPAC) est le (S)-2-amino-5-hydroxy-5-oxo-pentanoate de sodium .
Sa formule chimique est C5H8NNaO4 et sa masse molaire est de 169,13 g/mol.
Dans sa forme pure, le glutamate monosodique a l'apparence d'une poudre blanche et cristalline.
Le glutamate monosodique est l'un des sel de l'acide glutamique, un acide aminé naturel. Quand il est dissous dans l'eau, ou la salive, il se décompose rapidement en ions sodium et ion glutamate (le glutamate est la forme anionique de l'acide glutamique).
L'acide glutamique
Dans la culture alimentaire japonaise, l'acide glutamique est responsable de l'un des cinq goûts, l'umami. En tant que condiment et exhausteur de goût, il est fréquemment utilisé dans les cuisines asiatiques.
Utilisation
Le glutamate monosodique est un additif alimentaire autorisé par l'union européenne (E621[1]). Il est principalement utilisé sous sa forme mono hydraté[2]. Cependant d'autres sels de l'acide glutamique sont aussi utilisés[1] :
- Glutamate monopotassique (E622)
- Diglutamate de calcium (E623)
- Glutamate d’ammonium (E624)
- Diglutamate de magnésium (E625)
Les sels de l'acide glutamique sont autorisés dans les denrées alimentaires en général (à l’exception de celles mentionnées à l’article 2 paragraphe 3 de la directive 95/2/CE) jusqu'à un maximum de 10 g/kg seul ou en mélange. Il n'y a pas de limitation d'usage dans les condiments et assaisonnements (quantum satis (la))[1]. Ils appartiennent à la catégorie des exhausteurs de goût[3].
Toxicité chez l'homme
Le conseil européen de l'information sur l'alimentation (EUFIC) considère que « le glutamate monosodique est un ingrédient alimentaire qui souffre souvent d’une mauvaise réputation, pourtant infondée ». En se basant sur des études scientifiques publiées entre 1988 et 2000, l'organisme public affirme que « le glutamate monosodique peut être utilisé en toute sécurité pour ajouter du goût ou pour réduire les taux du sodium présent dans les aliments »[4].
L'avis de l'EUFIC contredit les études menées il y a plus de cinquante ans par D. R. Lucas et J. P. Newhouse. Ceux-ci affirmaient, en 1957, avoir observé la toxicité du glutamate quand, après avoir nourri des souris nouveau-nées avec du glutamate monosodique, ils ont constaté la destruction de neurones dans la couche interne de leur rétine[5].
Vers 1969, J. Olney affirma avoir découvert que ce phénomène n'était pas limité à la rétine, mais concernait tout le cerveau, et il le nomma alors excitotoxicité. Olney affirma également que cette mort cellulaire ne concernait que les neurones post-synaptiques, que la neurotoxicité des agonistes du glutamate était proportionnelle à leur efficacité à activer les récepteurs aux glutamates, et que les antagonistes des glutamates pouvaient inhiber cette neurotoxicité[6]. Le mécanisme de l'excitotoxicité serait désormais mieux connu. L'acide glutamique et ses analogues pourraient être responsables de l'hyperexcitation des récepteurs excitateurs neuronaux comme les récepteurs NMDA et AMPA. Ce mécanisme physiopathologique est incriminé dans un certain nombre de maladies neurologiques.
En 1986, l'administration américaine des denrées alimentaires et des médicaments (FDA) a déterminé que le glutamate monosodique (GMS) était GRAS (Generally Recognized As Safe, c'est-à-dire généralement reconnu comme sûr), mais que des réactions brèves peuvent apparaître chez certains individus. En 1995 un rapport de la Federation of American Societies for Experimental Biology (FASEB) a réaffirmé le caractère GRAS du GMS et n'a trouvé aucun lien entre le GMS et une toxicité à long terme (tel que les maladie d'Alzheimer et de Huntington) ou de toxicité chronique. Aucune évidence de causes de lésions cérébrales ou dommages nerveux n'a été décelée. Cependant le rapport a identifié des réactions complexes aux GMS dans deux groupes type d'individus. Le premier groupe concerne les personnes qui consomment une grande quantité de GMS (plus de 3 g par repas), en particulier à jeun. Une quantité typique de consommation est d'environ 0,5 gramme. Le second groupe inclut les personnes avec une forme sévère d'asthme[7].
Ils pourraient avoir d'autres effets secondaires[réf. nécessaire].
Notes et références
- ↑ a , b et c Parlement européen et Conseil de l'europe, « La Directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants », dans Journal officiel de l'Union européenne, no L 61, 20/02/1995, p. 1-56 [texte intégral (page consultée le 19/05/2008)].[pdf]
- ↑ Commission européenne, « DIRECTIVE 2001/30/CE modifiant la directive 96/77/CE établissant des critères de pureté spécifiques pour les additifs alimentaires autres que les colorants et les édulcorants », dans Journal officiel de l'Union européenne, no L 146, 2001 [texte intégral (page consultée le 11/07/2008)].
- ↑ (en) JECFA, « MONOSODIUM L-GLUTAMATE » sur www.fao.org, 2006, Jecfa Monograpf, FAO. Consulté le 11 juillet 2008.
- ↑ Le glutamate monosodique sur www.eufic.org, Novembre 2002, FOOD TODAY. Consulté le 11 juillet 2008.
- ↑ (en) Lucas DR, Newhouse JP. The toxic effect of sodium L-glutamate on the inner layers of the retina. AMA Arch Ophthalmol. 1957 Aug;58(2):193-201. PMID 13443577
- ↑ (en) Olney JW. Brain lesions, obesity, and other disturbances in mice treated with monosodium glutamate. Science 1969 May 9;164(880):719-21. PMID 5778021
- ↑ (en) Michelle Meadows, « MSG: A Common Flavor Enhancer » sur www.fda.gov, 2003, FDA/Office of Public Affairs. Mis en ligne le 06/01/2003., consulté le 11 juillet 2008.
Voir aussi
Articles connexes
- Excitotoxicité
- Neurotoxicité
- Récepteur du glutamate
- Aspartame
Liens externes
- Portail de la chimie
- Portail de l’agriculture et l’agronomie
Catégories : Composé du sodium | Sel d'acide carboxylique | Exhausteur de goût | Goût umami
Wikimedia Foundation. 2010.

