- 258-31-1
-
Hexacène
Hexacène 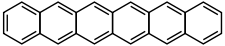
Structure de l'hexacèneGénéral Nom IUPAC hexacène No CAS PubChem ChEBI SMILES InChI Propriétés chimiques Formule brute C26H16 Masse molaire 328,4052 g∙mol-1
C 95,09 %, H 4,91 %,Propriétés physiques T° fusion 300 °C (décomposition) [1] Cristallographie Système cristallin triclinique [2] Classe cristalline ou
groupe d’espace [2]
[2]Paramètres de maille a = 7,9 Å
b = 6,1 Å
γ = 83,6 °
c = 18,4 Å
α = 102,7 °
β = 112,3 °
[2]Unités du SI & CNTP, sauf indication contraire. L'hexacène est un composé chimique de formule C26H16 appartenant à la famille des hydrocarbures aromatiques polycycliques (HAP) et composé de six noyaux benzéniques disposés linéairement. Comme pour ses dérivés, ses propriétés de semiconducteur organique font l'objet de recherches actives.
C'est une molécule très instable, particulièrement réactive au niveau des carbones n° 6 et 15 en raison de la localisation des électrons π. Son spectre doit être obtenu à partir d'échantillons récents maintenus sous atmosphère inerte d'azote ou d'argon. Il peut être isolé avec de grands substituants, notamment le 6,15-bis(tri-t-butylsilyléthynyl)hexacène, qui fond en se décomposant vers 96 °C[3].
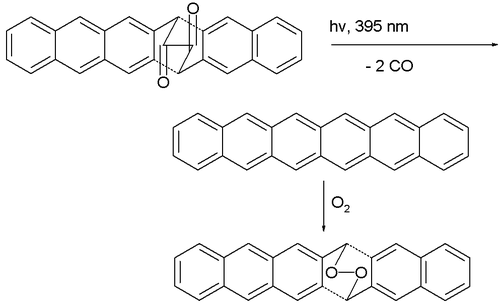
La première synthèse de l'hexacène pur remonte à 1942[4]. En 1955, il est produit par déshydrogénation d'hexacosadéshydrohexacène catalysée au palladium sur carbone[5]. En 1982, il est décrit comme un composé bleu vert qui se décompose vers 380 °C[6]. En 2007, une équipe a annoncé la première synthèse reproductible d'hexacène non substitué, invalidant du même coup les annonces antérieures, à partir de décarbonylation photochimique d'un précurseur dicétone[7] :
Deux phénomènes empêchent la purification de l'hexacène : il dimérise même à des concentrations aussi faibles que 10-4 M ; il est oxydé par l'air dissous. Cependant une matrice polymère en PMMA atténue suffisamment ces réactions pour permettre à l'hexacène d'y subsister une douzaine d'heures.
Références
- ↑ (de) E. Clar, « Hexacen, ein grüner, einfacher Kohlenwasserstoff », dans Chemische Berichte, vol. 72, no 10, 4 octobre 1939, p. 1818-1892
- ↑ a , b et c (en) R.B. Campbell, J. M. Robertson et J. Trotter, « The crystal structure of hexacene, and a revision of the crystallographic data for tetracene », dans Acta Crystallographica, vol. 15, no 5, mars 1962, p. 289-290
- ↑ Payne M. M., Parkin S. R., Anthony J. E., « Functionalized higher acenes: hexacene and heptacene », dans Journal of the American Chemical Society, vol. 127, no 22, 2005, p. 8028–8029(2) [lien DOI]
- ↑ E. Clar, « Eine neue Synthese des Hexacens (Aromatische Kohlenwasserstoffe, XXXIV. Mitteil.) », dans Berichte der deutschen chemischen Gesellschaft, vol. 75, no 11, 1942, p. 1283–1287(5) [lien DOI]
- ↑ William J. Bailey, Chien-Wei Liao, « Cyclic Dienes. XI. New Syntheses of Hexacene and Heptacene », dans J. Am. Chem. Soc., vol. 4, no 77, 1955, p. 992-993(2) [lien DOI]
- ↑ Angliker H., Rommel E., Wirz J., « Electronic spectra of hexacene in solution (ground state, triplet state, dication and dianion) », dans Chemical Physics Letters, vol. 87, no 2, 1982, p. 208–212(5) [lien DOI]
- ↑ Rajib Mondal, Ravi M. Adhikari, Bipin K. Shah, Douglas C. Neckers, « Revisiting the Stability of Hexacenes », dans Org. Lett., vol. 13, no 9, 2007, p. 2505-2508(4) [lien DOI]
Articles liés
- Portail de la chimie
Catégories : Hydrocarbure aromatique polycyclique | Semi-conducteur organique
Wikimedia Foundation. 2010.