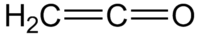Cétène (molécule)
- Cétène (molécule)
-
 Cet article concerne le composé chimique
Cet article concerne le composé chimique.
Pour le groupe chimique,
voir Cétène (groupe).
| Cétène (molécule) |
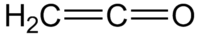
 |
| Général |
| Nom IUPAC |
éthènone |
| Synonymes |
carbométhène
céto-éthylène |
| No CAS |
463-51-4 |
| No EINECS |
207-336-9 |
| PubChem |
10038 |
| ChEBI |
48003 |
| SMILES |
|
| InChI |
InChI : Vue 3D
InChI= 1S/ C2H2O/ c1- 2- 3/ h1H2
|
| Propriétés chimiques |
| Formule brute |
C2H2O [Isomères]
|
| Masse molaire[2] |
42,0367 ± 0,002 g·mol-1
C 57,14 %, H 4,8 %, O 38,06 %,
|
| Moment dipolaire |
1,42215 D [1] |
| Propriétés physiques |
| T° fusion |
-150 °C [3] |
| T° ébullition |
-49 °C [3] |
| Limites d’explosivité dans l’air |
5,5 - 18 Vol%[4]. |
| Point critique |
65,0 bar, 106,85 °C [5] |
| Thermochimie |
| ΔfH0gaz |
-87,24 kJ·mol-1 [6] |
| ΔvapH° |
20,4 kJ·mol-1 [6] |
| Cp |
51,75 J·K-1·mol-1 (gaz,25 °C) [6]
équation[7] : 
Capacité thermique du gaz en J·mol-1·K-1 et température en kelvins, de 200 à 1 500 K.
Valeurs calculées :
47,09 J·mol-1·K-1 à 25 °C.
T
(K) |
T
(°C) |
Cp
 |
Cp
 |
| 200 |
-73,15 |
32 658 |
777 |
| 286 |
12,85 |
45 547 |
1 084 |
| 330 |
56,85 |
50 844 |
1 210 |
| 373 |
99,85 |
55 305 |
1 316 |
| 416 |
142,85 |
59 150 |
1 407 |
| 460 |
186,85 |
62 533 |
1 488 |
| 503 |
229,85 |
65 381 |
1 555 |
| 546 |
272,85 |
67 849 |
1 614 |
| 590 |
316,85 |
70 047 |
1 666 |
| 633 |
359,85 |
71 937 |
1 711 |
| 676 |
402,85 |
73 625 |
1 751 |
| 720 |
446,85 |
75 191 |
1 789 |
| 763 |
489,85 |
76 607 |
1 822 |
| 806 |
532,85 |
77 943 |
1 854 |
| 850 |
576,85 |
79 257 |
1 885 |
|
T
(K) |
T
(°C) |
Cp
 |
Cp
 |
| 893 |
619,85 |
80 512 |
1 915 |
| 936 |
662,85 |
81 753 |
1 945 |
| 980 |
706,85 |
83 020 |
1 975 |
| 1 023 |
749,85 |
84 256 |
2 004 |
| 1 066 |
792,85 |
85 490 |
2 034 |
| 1 110 |
836,85 |
86 738 |
2 063 |
| 1 153 |
879,85 |
87 929 |
2 092 |
| 1 196 |
922,85 |
89 070 |
2 119 |
| 1 240 |
966,85 |
90 156 |
2 145 |
| 1 283 |
1 009,85 |
91 103 |
2 167 |
| 1 326 |
1 052,85 |
91 897 |
2 186 |
| 1 370 |
1 096,85 |
92 502 |
2 201 |
| 1 413 |
1 139,85 |
92 837 |
2 208 |
| 1 456 |
1 182,85 |
92 858 |
2 209 |
| 1 500 |
1 226,85 |
92 488 |
2 200 |
|
|
| Propriétés électroniques |
| 1re énergie d'ionisation |
9,617 ± 0,003 eV (gaz)[8] |
| Précautions |
|
NFPA 704[9]
|
|
|
|
SIMDUT[10]
|
  D1A, F,
D1A, F, |
| Écotoxicologie |
| DL50 |
1,3 g·kg-1 (rat, oral) [10] |
|
Unités du SI & CNTP, sauf indication contraire.
|
Le cétène est un gaz toxique de formule semi-développée H2C=C=O, instable dans les conditions normales de température et de pression. Son tautomère est l'éthynol.
Propriétés physico-chimiques
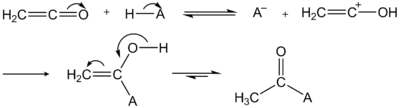
Le cétène est un agent d'acétylation très puissant[3].
Utilisation
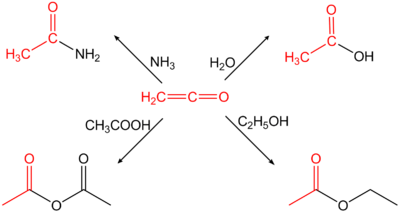
La majeure partie de la production du cétène est utilisée pour la production de l'anhydride acétique. Toutefois ce procédé est concurrencé par la carbonylation de l'acétate de méthyle[3].

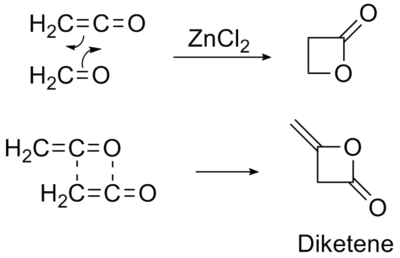
La seconde utilisation du cétène est la production du dicétène par dimérisation contrôlée[3].
La réaction du cétène avec le crotoaldéhyde produit le bêta-lactone ou du polyester. Ces derniers sont ensuite convertis par voie thermique ou par voie catalytique en acide sorbique[3].
Production et synthèse
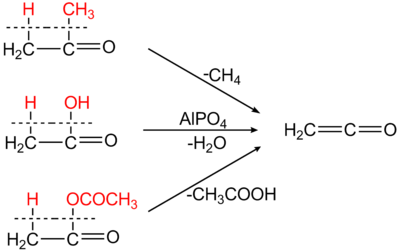
La principale voie de synthèse du cétène est la pyrolyse de l'acide acétique. Ce dernier est évaporé et chauffé à une température de 740 à 760 °C, puis du phosphate de triéthyle est ajouté comme catalyseur ainsi que de l'ammoniaque. L'ammoniaque empêche la recombinaison de l'eau et du cétène. Le mélange est ensuite refroidi à moins de 100 °C pour condenser l'eau et l'acide acétique n'ayant pas réagi, le cétène est alors absorbé dans un liquide de conditionnement ou récupéré sous forme de dicétène via une pompe à vide[3].
Notes et références
- ↑ (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- ↑ Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- ↑ a, b, c, d, e, f et g (en) Raimund Miller, Claudio Abaecherli, Adel Said, Barry Jackson, Ketenes, Wiley-VCH Verlag GmbH & Co, coll. « Ullmann's Encyclopedia of Industrial Chemistry », 15 septembre 2001
- ↑ Entrée de « Ketene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 25 novembre 2009 (JavaScript nécessaire)
- ↑ Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- ↑ a, b et c (en) « Ketene » sur NIST/WebBook, consulté le 25 novembre 2009
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 0-88415-857-8)
- ↑ (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- ↑ UCB Université du Colorado
- ↑ a et b « Cétène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 novembre 2009
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article Cétène (molécule) de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
Cétène (groupe) — Cet article concerne le groupe chimique. Pour le composé chimique, voir Cétène (molécule). Un cétène est un composé organique contenant la séquence : . Ils ont été découverts vers 1905, par Hermann Staudinger alors âgé de 26 ans pendant un… … Wikipédia en Français
Cétène — Cette page d’homonymie répertorie les différents sujets et articles partageant un même nom. Les cétènes, groupe de molécules de formule R1,R2C=C=O. Le cétène, molécule de formule H2C=C=O … Wikipédia en Français
Cetene — Cétène Un cétène est un composé organique contenant la séquence : Formation et mécanisme À partir d un chlorure d acyle portant un hydrogène en α. Une base, généralement la triéthylamine, va arracher le proton acide en α du groupement… … Wikipédia en Français
ANHYDRIDES D’ACIDES CARBOXYLIQUES — Comme leur nom l’indique, les anhydrides d’acides dérivent des acides carboxyliques par perte d’eau. Leur formule, R 漣CO 漣O 漣CO 漣R, correspond à la déshydratation d’un couple d’acides identiques; toutefois il existe des anhydrides mixtes… … Encyclopédie Universelle
RÉACTIONNELS (MÉCANISMES) — La loi de Lavoisier permet de définir pour toute réaction chimique un bilan matériel qui est habituellement exprimé sous la forme d’une ou de plusieurs équations de réaction. Un tel bilan ne traduit que d’une façon globale l’ensemble des… … Encyclopédie Universelle
Liste de molecules detectees dans le milieu interstellaire — Liste de molécules détectées dans le milieu interstellaire Cet article est une liste de molécules qui ont été détectée dans le milieu interstellaire, groupées par nombre d atomes constituant. La formule brute de chaque composé est mentionnée,… … Wikipédia en Français
Liste de molécules détectées dans le milieu interstellaire — Cet article est une liste de molécules qui ont été détectées dans le milieu interstellaire, groupées par nombre d atomes constituant. La formule brute de chaque composé est mentionnée, ainsi que toute forme ionisée qui aurait éventuellement été… … Wikipédia en Français
Groupe fonctionnel — En chimie organique, un groupe fonctionnel est une structure sub moléculaire constituée d un assemblage d atomes donnés qui confère une réactivité propre à la molécule qui le contient. Cette manière de considérer les molécules comme étant un… … Wikipédia en Français
1,3-déshydroadamantane — Propellane de gauche à droite : [1.1.1]propellane, [2.2.2]propellane, 1,3 dehydroadamantane Les propellanes sont une classe d hydrocarbures saturés ou alcanes tricycliques c est à dire avec deux atomes de carbone tête de pont et quatre… … Wikipédia en Français
Acylation — En chimie organique, une acylation est une réaction au cours de laquelle un groupement acyle est ajouté à une molécule, ce groupement étant transféré depuis un agent acylant. Les halogénures d acyle sont très utilisés comme agents acylants. En… … Wikipédia en Français