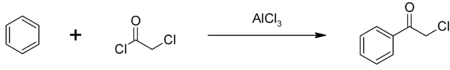- Chlorure de chloroacétyle
-
Chlorure de chloroacétyle 
Général Nom IUPAC Chlorure de chloroacétyle No CAS No EINECS SMILES InChI Apparence Liquide incolore à jaunâtre, à l'odeur âcre Propriétés chimiques Formule brute C2H2Cl2O [Isomères] Masse molaire[1] 112,943 ± 0,006 g·mol-1
C 21,27 %, H 1,78 %, Cl 62,78 %, O 14,17 %,Propriétés physiques T° fusion -22,5 °C[2] T° ébullition 105 °C Solubilité se décompose violemment dans l'eau Masse volumique 1 417 g·cm-3 (20 °C) Point d’éclair > 100 °C Pression de vapeur saturante 25,3 mbar à 20 °C
230 mbar à 65 °CPrécautions Directive 67/548/EEC[2] 
T
C
NPhrases R : 14, 23/24/25, 29, 35, 48/23, 50, Phrases S : (1/2), 7, 8, 26, 36/37/39, 45, 61, Transport 668 1752 Écotoxicologie DL50 220 mg (souris, oral)[3]
32 mg·kg-1 (souris, i.v.)[4]CL50 1 300 ppm/2H (souris, inhalation)[5] LogP -0,220[6] Unités du SI & CNTP, sauf indication contraire. Le chlorure de chloroacétyle est un composé de la famille des chlorures d'acyle chlorés. Composé bifonctionnel, il est intéressant comme « bloc de construction » chimique, mais d'une double réactivité, il se comporte violemment en diverses circonstances.
Sommaire
Propriétés[2]
Le chlorure de chloroacétyle est un liquide très peu inflammable (point d'éclair au dessus de 100 °C), qui se décompose violemment dans l'eau. Il dégage de la fumée en présence d'humidité dans l'air. Il se décompose s'il est chauffé, notamment en chlorure d'hydrogène, dichlore, phosgène et dioxines. Il réagit violemment avec les alcools, l'eau, les bases ou les métaux alcalins, et les poudres métalliques.
Synthèse
Industriellement, il est produit par carbonylation du dichlorométhane, l'oxydation du 1,1-dichloroéthène, ou par l'addition de dichlore au cétène[7]. Il peut aussi être préparé à partir de l'acide chloroacétique et du chlorure de thionyle, du pentachlorure de phosphore ou du phosgène.
Réactions
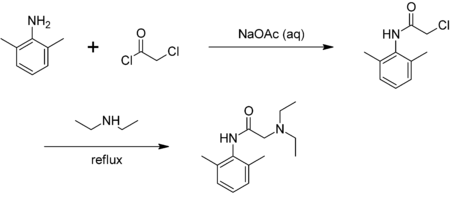
Le chlorure de chloroacétyle est bifonctionnel : la partie chlorure d'acyle forme facilement des esters[8] et des amides, tandis que l'autre partie de la molécule est capable de former d'autre types de liens, par exemple avec les amines. Dans l'exemple qui suit, le chlorure de chloroacétyle est utilisé dans la synthèse de la lidocaïne[9], en formant un amide par réaction avec la 2,6-xylidine (2,6-diméthylaniline) :
Applications
Du fait de sa double réactivité, le chlorure de chloroacétyle est utilisé dans de nombreuses synthèses organiques. Il est notamment utilisé comme intermédiaire dans la production de l'alachlore et du butachlore. Le chlorure de chloroacétyle est aussi utilisé dans la production de chlorure de phénacyle, un autre intermédiaire chimique, utilisé aussi comme gaz lacrymogène[7]. Le chlorure de phénacyle est synthétisé par acylation de Friedel-Crafts sur le benzène, catalysée par le trichlorure d'aluminium[10] :
Précautions
Comme la plupart des chlorures d'acyle, il réagit avec d'autres composés protiques, comme les amines, les alcools, ou l'eau, ce qui produit du chlorure d'hydrogène, et le rend lacrymogène.
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Chloroacetyl chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 13/11/2010 (JavaScript nécessaire)
- Gigiena i Sanitariya. For English translation, see HYSAAV. Vol. 54(2), Pg. 90, 1989.
- U.S. Army Armament Research & Development Command, Chemical Systems Laboratory, NIOSH Exchange Chemicals. Vol. NX#04538
- "Documentation of the Threshold Limit Values and Biological Exposure Indices," 5th ed., Cincinnati, OH, American Conference of Governmental Industrial Hygienists, Inc., 1986Vol. 5, Pg. 123(89), 1986.
- (en) « Chloroacetyl chloride » sur ChemIDplus, consulté le 13/11/2010
- (en) Paul R. Worsham, Acetic acid and its derivatives, New York, M. Dekker, 1993, Google Books excerpt (ISBN 0-8247-8792-7) [lire en ligne], « 15. Halogenated Derivatives », p. 288–298
- Robert H. Baker and Frederick G. Bordwell (1955). "tert-Butyl acetate". Org. Synth.; Coll. Vol. 3.
- T. J. Reilly, « The Preparation of Lidocaine », dans J. Chem. Ed., vol. 76, no 11, 1999, p. 1557 [texte intégral, lien DOI]
- Nathan Levin and Walter H. Hartung (1955). "ω-Chloroisonitrosoacetophenone". Org. Synth.; Coll. Vol. 3: 191.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Chloroacetyl chloride » (voir la liste des auteurs)
Catégories :- Produit chimique toxique
- Produit chimique corrosif
- Produit chimique dangereux pour l'environnement
- Chlorure d'acyle
Wikimedia Foundation. 2010.