- Acide chlorosulfurique
-
Acide chlorosulfurique 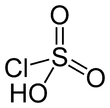
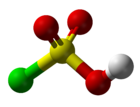
Structure de l'acide chlorosulfuriqueGénéral Synonymes acide chlorosulfonique No CAS No EINECS No RTECS PubChem SMILES InChI Apparence liquide incolore hygroscopique Propriétés chimiques Formule brute HSO3Cl Masse molaire[1] 116,524 ± 0,008 g·mol-1
H 0,87 %, Cl 30,43 %, O 41,19 %, S 27,52 %,Propriétés physiques T° fusion -80 °C T° ébullition 151 à 152 °C Précautions Directive 67/548/EEC[2] 
CPhrases R : 14, 35, 37, Phrases S : 2, 26, 45, Transport[2] 88 1754 NFPA 704 SGH[2],[3] 
DangerUnités du SI & CNTP, sauf indication contraire. L’acide chlorosulfurique, également appelé acide chlorosulfonique ou chlorhydrine sulfurique, est un composé chimique (acide, toxique et dangereux[4]) de formule HSO3Cl, obtenu par mélange d'oléum et d'acide nitrique.
C'est un liquide incolore, hygroscopique, lacrymogène[5], à manipuler avec précaution car il se décompose violemment au contact de l'eau en acide chlorhydrique et acide sulfurique.
Il a été utilisé comme gaz de combat durant la Grande guerre[6].
Sommaire
Description, structure et propriétés
Formellement et chimiquement, il est intermédiaire entre le chlorure de sulfuryle SO2Cl2 et l'acide sulfurique H2SO4[7]. Ce composé est rarement obtenu pur. Sa molécule est tétraédrique.
Cet acide se décompose en chlorures de pyrosulfuryles sous excès de trioxyde de soufre SO3[8] :
- 2 HSO3Cl + SO3 → H2SO2 + modifier] Synthèse et production
On le produit industriellement en faisant réagir du chlorure d'hydrogène HCl avec une solution de trioxyde de soufre SO3 dans de l'acide sulfurique H2SO4 :
Au laboratoire, on peut le préparer par chloration de l'acide sulfurique :
Il a par exemple en France été produit par Rhône-Poulenc Chimie (devenu Rhodia, à partir de 1925 et avec une capacité de 100 tonnes/semaine, par mélange gravitaire, dans le secteur dit Secteur ANS : du site Rhodia opération SAS (Nord) (aujourd'hui fermé)
Usages
- Il a été utilisé par l'armée allemande durant la Première guerre mondiale comme arme chimique (en chargement d'obus chimiques ou de grenades à main (sphères de verre de 85 mm de diamètre, dite « Hand-A-Stink-Kugel, de 250 ml de capacité. Le premier antidote utilisé par les français fut l'hyposulfite (en compresse d'abord, puis dans des appareils respiratoires). Quand ces mêmes grenades contenaient de la bromacétone industrielle, elles portaient une couche de peinture jaune sur l’ampoule en verre, à sa partie supérieure).
De leur côté, les français ont produit des grenades contenant une combinaison d'anhydride sulfurique et de chlorhydrine sulfurique (C Stoff) provoquant des « fumées opaques, légèrement suffocantes. En contact avec la peau, il provoquait des brûlures graves et douloureuses. Il irritait très fortement les yeux dès 5 mg·m-3. Sa toxicité n’était pas négligeable en milieu clos où une concentration de 3 000 mg·m-3 était mortelle en une minute »[6].
Il semble aussi avoir été utilisé lors de la seconde guerre mondiale dans certains fumigènes[9].
- L'acide chlorosulfurique est utilisé pour produire des acides sulfoniques R–SO2OH, qui sont des intermédiaires de synthèse importants et entrent dans la composition de certains détergents :
- R–OH + HSO3Cl → R–O–SO2–OH + HCl.
- Il est également utilisé comme réactif de laboratoire.
Toxicologie
Il est hautement toxique pour les voies respiratoires et muqueuses pulmonaires qu'il détruit. C'est un produit très corrosif à étiqueter en Europe, conformément à la "Directive générale de classification pour les Substances de la CE", Dir. 67/548/CE, dans sa dernière version [4].
- R 14 Réagit violemment au contact de l'eau.
- R 35 Provoque de graves brûlures.
- R 37 Irritant pour les voies respiratoires.
C'est un irritant primaire de la peau qu'il corrode rapidement, ainsi que les muqueuse et yeux.
Il peut être nocif en cas d'ingestion « L'absorption orale du produit a un fort effet corrosif sur la cavité buccale et le pharynx et présente un danger de perforation du tube digestif et de l'estomac » [4].
Toxicité aiguë:
Il ne semble pas sensibilisant.
Écotoxicologie
Dilué, il n'est pas classé parmi les polluants importants de l'eau, mais « Il ne doit pas pénétrer à l'état non dilué ou non neutralisé dans les eaux usées ou le collecteur » [4].
Références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Chlorosulfonic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 mars 2011 (JavaScript nécessaire)
- SIGMA-ALDRICH
- Fiche de sécurité du produit conforme au règlement 1907/2006/CE, Article 31 (version consultée :02.03.2009)
- (en) R. J. Cremlyn, « Chlorosulfonic Acid », Royal Society of Chemistry, Springer-Verlag New York, Inc. 2002, 300 pages. ISBN 978-0-85404-498-6.
- La guerre des gaz, Les munitions chimiques allemandes, 1914 à 1915. (voir chapitre intitulé De nouvelles substances agressives, et Thèse de pharmacie sur le même sujet
- (en) A. F. Holleman et E. Wiberg, « Inorganic Chemistry » Academic Press, San Diego, 2001, pages 549-550 (discussion sur XSO2OH avec X = F, Cl, Br, I)
- (en) Joachim Maas et Fritz Baunack, « Chlorosulfuric Acid » dans « Ullmann's Encyclopedia of Industrial Chemistry » 2002, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a07_017
- Jean Philippon, [Services secrets contre cuirassés: Brest, 1940-1942 ] ; Nouvelles Editions Latines, 2000 - 252 pages
Voir aussi
Articles connexes
- Industrie chimique
- Chimie du chlore
- Acide sulfurique
- Liste des acides
- Rhodia
Bibliographie
- Règlement (CE) no 1907/2006 du Parlement européen et du Conseil du 18 décembre 2006, REACh.
- Il a été utilisé par l'armée allemande durant la Première guerre mondiale comme arme chimique (en chargement d'obus chimiques ou de grenades à main (sphères de verre de 85 mm de diamètre, dite « Hand-A-Stink-Kugel, de 250 ml de capacité. Le premier antidote utilisé par les français fut l'hyposulfite (en compresse d'abord, puis dans des appareils respiratoires). Quand ces mêmes grenades contenaient de la bromacétone industrielle, elles portaient une couche de peinture jaune sur l’ampoule en verre, à sa partie supérieure).
Catégories :- Produit chimique corrosif
- Produit chimique qui réagit avec l'eau
- Oxoacide de soufre
- Acide sulfonique
- Lacrymogène
- Chlorure de sulfonyle
- 2 HSO3Cl + SO3 → H2SO2 + modifier] Synthèse et production
Wikimedia Foundation. 2010.


