- Époxyéthane
-
Oxyde d'éthylène
Oxyde d'éthylène 
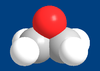
Structure de l'oxyde d'éthylène Général Synonymes 1,2-Epoxyéthane
OxiraneNo CAS No EINECS FEMA Apparence gaz comprimé liquefié incolore, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C2H4O [Isomères] Masse molaire 44,0526 g∙mol-1
C 54,53 %, H 9,15 %, O 36,32 %,Propriétés physiques T° fusion -111 °C[1] T° ébullition 11 °C[1] Solubilité dans l'eau : miscible[1] Masse volumique (eau = 1) : 0.9[1] T° d’auto-inflammation 429 °C[1] Point d’éclair -20 °C Limites d’explosivité dans l’air en volume % dans l'air : 3-100[1] Pression de vapeur saturante à 20 °C : 146 kPa[1] Thermochimie S0gaz, 1 bar 243 J/mol·K S0liquide, 1 bar 149,45 J/mol·K ΔfH0gaz -52.6 kJ/mol ΔfH0liquide -96 kJ/mol Cp 86.9 J/mole·K (liquide) Précautions Directive 67/548/EEC 
T
F+Phrases R : 12, 23, 36/37/38, 45, 46, Phrases S : 45, 53, [2] Transport 263 1040 NFPA 704 SIMDUT[4] 




SGH[5] 



DangerClassification du CIRC Groupe 1 : Cancérogène pour l'homme[3] Inhalation irritation des poumons, convulsions Yeux dangereux Écotoxicologie LogP -0.3[1] Unités du SI & CNTP, sauf indication contraire. L'oxyde d'éthylène, ou 1,2-époxyéthane, oxyde de diméthylène, oxacyclopropane, ou encore oxirane est un composé organique, le plus simple de la classe des époxydes. Il est important pour l'industrie chimique, entre autres dans la production d'éthylène glycol, ainsi que dans les industries pharmaceutique et agroalimentaire.
Sommaire
Histoire
L'oxyde d'éthylène fut synthétisé pour la première fois par Charles Wurtz en 1859, en faisant réagir du 2-chlorométhanol avec une base. Il prit vraiment une importance aux yeux des industriels durant la Première Guerre mondiale, où il servit à fabriquer l'éthylène glycol (en tant que réfrigérant) et le gaz moutarde.
En 1931, Théodore Lefort découvrit une autre méthode de synthèse, directement à partir d'éthylène et de dioxygène réagissant grâce à catalyseur à base d'argent. Depuis les années 1940, c'est cette méthode qui sert à produire quasiment tout l'oxyde d'éthylène industriel.
Production
L'oxyde d'éthylène est produit industriellement grâce à un mélange de dioxygène et d'éthylène qui réagissent entre 200 °C et 300 °C sur un catalyseur d'argent, selon l'équation chimique:
Le rendement atteint généralement 70-80%, les pertes étant dues à la combustion de l'éthylène produisant du dioxyde de carbone. Plusieurs méthodes pour produire de l'oxyde d'éthylène plus sélectivement ont été proposées, mais aucune n'a encore atteint un stade industriel.
Utilisation
L'oxyde d'éthylène gazeux sert à tuer les bactéries (et leurs endospores, contrairement à de nombreux autres produits), les moisissures et les champignons, et c'est pourquoi on l'utilise pour stériliser des substances que des techniques reposant sur la chaleur, comme la pasteurisation, pourraient endommager. La stérilisation des épices par l'oxyde d'éthylène fut brevetée en 1938 par l'américain Lloyd Hall, et est encore employée de nos jours. On l'utilise aussi dans la stérilisation du matériel médical tel que les bandages, les sutures, les implants, etc.
Cependant, la majeure quantité d'oxyde d'éthylène industriel est utilisée comme intermédiaire dans la fabrication d'autres produits chimiques, comme l'éthylène glycol employé en tant que réfrigérant et antigel dans les automobiles, ou pour produire des polyethers.
L'oxyde d'éthylène lui-même peut polymériser et former du polyéthylène glycol ou de l'oxyde de polyéthylène, qui sont des polymères solubles dans l'eau et non-toxiques.
L'oxyde d'éthylène est aussi important dans l'industrie des détergents, dans un procédé appelé éthoxylation.
Un des types de dérivés de l'oxyde d'éthylène qui a le plus intéressé les chimistes sont les éthers en couronne, qui sont des oligomères cycliques de l'oxyde d'éthylène, possédant la propriété de former des composés ioniques dans des solvants non polaires. Cependant, leur prix prohibitif les a confinés au laboratoire.
Toxicité
L'oxyde d'éthylène sous forme gazeuse est toxique, et des surexpositions peuvent causer des maux de tête, s'intensifiant au fur et à mesure de l'exposition, pouvant même mener à des convulsions voire au coma. C'est aussi un produit irritant pour la peau et les poumons, et son inhalation peut conduire à une inondation de ces derniers plusieurs heures après. L'exposition répétée augmente également le risque de cataracte.
L'oxyde d'éthylène est classé cancérogène pour l'homme par le Centre International de Recherche sur le Cancer.
Chez les animaux, l'oxyde d'éthylène peut provoquer de nombreux effets sur la reproduction, tel que des mutations ou des fausses couches. Ses effets sur la reproduction humaine n'ayant pas été étudiés en profondeur, on ne peut que conjecturer que l'oxyde d'éthylène produise les mêmes effets chez les humains.
Notes et références
- ↑ a , b , c , d , e , f , g , h et i OXYDE D'ETHYLENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « oxyde d'éthylène » sur ESIS, consulté le 17 février 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 1 : Cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Oxyde d'éthylène » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique extrêmement inflammable | Cancérogène chimique | Produit chimique mutagène | Produit chimique corrosif | Monomère | Époxyde
Wikimedia Foundation. 2010.



