- Trinitrine
-
Nitroglycérine
Nitroglycérine 
structure du trinitrate de glycérine Général Nom IUPAC 1,2,3-tris-nitrooxy-propane Synonymes Trinitrate de glycérol
Nitroglycérol
TrinitrineNo CAS No EINECS Code ATC C01 SMILES InChI Apparence Liquide légèrement huileux
à température ambiante.
Incolore à l'état pur et
jaune en milieu acidePropriétés chimiques Formule brute C3H5N3O9 [Isomères]
CH2(ONO2)-CH(ONO2)-CH2(ONO2)Masse molaire 227,0865 g∙mol-1
C 15,87 %, H 2,22 %, N 18,5 %, O 63,41 %,Propriétés physiques T° fusion 13,5 °C (rhombique)[1]
2,8 °C (triclinique)[1]T° ébullition 160 °C (20 hPa)[1]
Explosion à 218 °C[1]Solubilité dans l'eau : faible[2] Masse volumique 1,5931 à 20 °C[1] T° d’auto-inflammation 270 °C[1] Vitesse de détonation (cylindre de 30 mm) environ 7 500 m/s Pression de vapeur saturante à 20 °C : 0.03 Pa[2] Précautions Directive 67/548/EEC 
T+
E
NPhrases R : 3, 26/27/28, 33, 51/53, Phrases S : (1/2), 33, 35, 36/37, 45, 61, Transport 33 1204
33 3064 NFPA 704 SGH[3],[4] 



Danger




DangerUnités du SI & CNTP, sauf indication contraire. La nitroglycérine, ester trinitrique du glycérol, trinitroglycérine, trinitrate de glycérol ou trinitrine est un composé chimique liquide dense, incolore, huileux, explosif et hautement toxique, obtenu par nitration du glycérol. Il est utilisé dans la fabrication d'explosifs, et plus particulièrement de la dynamite, dont on se sert dans les industries de la construction et de la démolition. Il peut également avoir un usage médical, comme vasodilatateur. Lors de sa décomposition, la nitroglycérine prend une teinte jaune en raison de l'acidification du milieu.
Le trinitrotoluène (TNT) est un autre explosif.
Sommaire
Histoire
La nitroglycérine a été découverte par Ascanio Sobrero en 1847, lorsqu'il travaillait avec Théophile-Jules Pelouze à l'université de Turin. Le processus de fabrication industrielle a été élaboré par Alfred Nobel dans les années 1860. Sa société a exporté un mélange de nitroglycérine et de poudre à canon appelé « huile suédoise détonante », qui a été rapidement interdit suite à des accidents catastrophiques. Il découvrit également en 1866 qu'on pouvait stabiliser la nitroglycérine en la mélangeant à un sable siliceux d'origine naturelle : le kieselguhr. Par la suite, cela a abouti au développement de la dynamite et des mélanges similaires (dualine et lithofracteur), où l'on ajoute à la nitroglycérine des composés inertes ou des combustibles absorbants (par exemple la nitrocellulose pour fabriquer un gel de couleur jaune, la gélatine explosive).
Fabrication
La nitroglycérine est fabriquée en laboratoire par la nitration de la glycérine (glycérol) obtenue par ajout à un mélange d'acide sulfurique et nitrique .
- C3H5(OH)3 + 3HNO3 → C3H5(NO3)3 + 3H2O
La température ne doit pas dépasser les 30 °C lors de la réaction sous risque d'explosion. La nitroglycérine se stabilise et est lavée par l'eau et du carbonate de sodium jusqu'à ce qu'elle devienne neutre. Cette réaction chimique extrêmement dangereuse est réalisée par des professionnels dans des laboratoires spécialement équipés. Emil Nobel, le frère d'Alfred Nobel, en est mort tragiquement.
Voici la méthode utilisée par E. Kopp au XIXème siècle. Ce dernier utilise un mélange à part égale d'acide nitrique fumant et d'acide sulfurique à 66°Baumé (d=1,83). Le mélange est versé dans un ballon maintenu dans un bac de réfrigérant. On verse dans ce mélange la glycérine (environ la moitié du poids de l'acide nitrique), l'opération doit être faite en agitant constamment lentement et en maintenant le liquide à moins de 20 °C. Le liquide obtenu doit être versé dans une grande quantité d'eau froide. L'éther trinitrique de la glycérine couramment appelé nitroglycérine vient se déposer au fond du récipient.
Cette opération NE DOIT PAS être réalisée par un particulier, même refroidie la trinitroglycérine est TRÈS INSTABLE et peut se décomposer en une violente EXPLOSION. La nitroglycérine ainsi obtenue contient des trace d'eau et de ce fait ne peut se conserver. Elle doit donc être purifiée de son eau.Propriétés
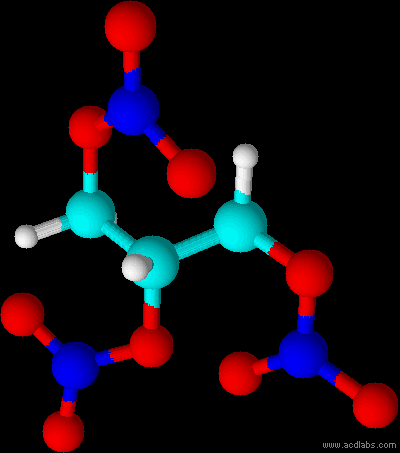 Vue en trois dimension d'une molécule de nitroglycérine.
Vue en trois dimension d'une molécule de nitroglycérine.
C'est une matière très sensible à la friction, aux chocs, aux élévations de température et aux étincelles. Sa sensibilité au choc est cependant relative – et bien moindre que ce que prétend la légende (véhiculée par le cinéma pour son côté spectaculaire, notamment dans le film Le Salaire de la peur). En effet, une goutte de nitroglycérine, lâchée d'une hauteur d'environ un mètre cinquante (c'est-à-dire la taille de l'acteur dans le film cité), ou même de plusieurs dizaines de mètres (au-delà, sa vitesse n'augmente plus à cause de la résistance de l'air) n'a aucune chance d'exploser, l'énergie du choc étant absorbée par sa déformation. Des tests ont démontré qu'un flacon de verre rempli de nitroglycérine, mais totalement exempt de toute trace de produit sur sa paroi externe, pouvait être précipité d'une falaise et se briser sur les rochers sans exploser. Par contre, le même flacon, lâché d'une hauteur de quelques centimètres à peine sur un sol dur (métal, pierre), explosait à coup sûr si le flacon (ou le sol) était recouvert d'une fine couche de nitroglycérine (lors du contact avec le sol, le film externe de nitroglycérine subit une véritable percussion entre deux matières dures, ce qui provoque sa détonation, puis, par un phénomène dit « de sympathie », l'explosion de la nitroglycérine contenue dans le flacon). Des suintements sur les parois des récipients utilisés pour son transport seraient donc à l'origine d'accidents attribués à tort à la grande sensibilité de la nitroglycérine. Toutefois, taper dessus au marteau reste une très mauvaise idée : soumise à un choc énergique et concentré, elle explose selon un premier régime de détonation, situé aux alentours de 2 000 m/s. Si on l'amorce au moyen d'un détonateur convenable, sa vitesse de détonation dépasse alors les 7 000 m/s. Sans que l'on puisse encore en expliquer la raison ni le mécanisme, la nitroglycérine est ainsi le seul explosif connu à posséder deux régimes de détonation. Beaucoup de chimistes amateurs sont morts en essayant d'en fabriquer ou d'en stocker.
Stabilité
Dans sa forme pure, la nitroglycérine est stable et peut être conservée sans limite de temps (un échantillon préparé par Sobrero est ainsi toujours conservé à Turin, dans l'obscurité). En revanche, si elle conserve des traces d'acide de sa fabrication, elle se dégrade en quelques jours en devenant verdâtre (dégagement de gaz nitreux) et devient alors extrêmement dangereuse à manipuler.
On s'est assez vite rendu compte qu'elle pouvait être « désensibilisée » en la refroidissant jusqu'à la solidifier. Malheureusement, le processus de réchauffement nécessaire pour pouvoir ensuite s'en servir était également risqué. Une autre manière de la désensibiliser est de la diluer à l'aide d'un solvant, comme l'éthanol ou l'acétone. Enfin, on peut aussi la faire absorber par des matières inertes (kieselguhr, sciure...) ou actives (nitrates alcalins, nitrocellulose, autres explosifs... ) : on obtient ainsi des dynamites, dites respectivement à base inerte ou active. Des centaines de formulations existent, qui permettent la préparation de dynamites avec des caractéristiques très précises.
Usage médical
En médecine, la nitroglycérine, appelée dans ce cas trinitrine (ainsi que d'autres nitrates organiques), peut être utilisée à petites doses dans certaines affections cardiaques, comme l'angine de poitrine sous forme de comprimés, de pulvérisations sous la langue (voie sublinguale), de perfusion intraveineuse continue ou de timbres (patch) transdermique.
Le principal effet est la vasodilatation, c'est-à-dire l'élargissement des vaisseaux sanguins, ce qui permet d'augmenter le débit des coronaires et de diminuer la pression artérielle. La nitroglycérine est transformée par le corps en oxyde nitrique par le biais d'une enzyme, l'aldéhyde déshydrogénase mitochondriale (ALDH), qui la dégrade dans les mitochondries. L'oxyde nitrique produit alors l'effet vasodilatateur. L'effet de l'ALDH fut découvert récemment (2002) par Jonathan Stamler et Zohiqiang Chen, de l'université Duke, à Durham, en Caroline du Nord. Il est à noter qu'Alfred Nobel, inventeur de la dynamite qui souffrait d'une cardiopathie, aurait pu être soigné aujourd'hui avec ce produit qu'il employait pour un tout autre usage.
Voir aussi
Références
- ↑ a , b , c , d , e , f et g Entrée de « Glycerol trinitrate » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 12 avril 2009 (JavaScript nécessaire)
- ↑ a et b NITROGLYCERINE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
- Portail de la pharmacie
Catégories : Produit chimique très toxique | Produit chimique explosif | Produit chimique dangereux pour l'environnement | Antiangoreux | Explosif | Nitrate
Wikimedia Foundation. 2010.


