- Arsine
-
Trihydrure d'arsenic
Trihydrure d'arsenic 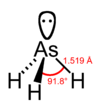

Trihydrure d’arsenic : structure chimique Général Synonymes Trihydrure d’Arsenic,
Hydrogène Arsenié,
ArsineNo CAS No EINECS Apparence gaz comprime liquefie, incolore, d'odeur caracteristique.[1] Propriétés chimiques Formule brute AsH3 Masse molaire 77,94542 g∙mol-1
H 3,88 %, As 96,12 %,Propriétés physiques T° fusion -116 °C[1] T° ébullition -62 °C[1],
décomposition à 300 °CSolubilité dans l'eau à 20 °C : 20 ml/100 ml[1] Masse volumique vapeur 2,7 (air : 1) Point d’éclair Gaz Inflammable[1] Limites d’explosivité dans l’air en volume % dans l'air : 4.5-78[1] Pression de vapeur saturante à 20 °C : 1043 kPa[1] Précautions Directive 67/548/EEC 
T+
F+
NPhrases R : 12, 26, 48/20, 50/53, Phrases S : (1/2), 9, 16, 28, 33, 36/37, 45, 60, 61, [2] Transport 263 2188 [3]NFPA 704 SIMDUT[4] 


SGH[5] 




DangerInhalation Peut provoquer des vertiges, un œdème pulmonaire et des troubles cardiaques. Le décès peut survenir en cas d’exposition massive. Peau Pénétration cutanée possible. Ingestion Peut provoquer des nausées, des vomissements, des douleurs abdominales. Unités du SI & CNTP, sauf indication contraire. À température ordinaire, le trihydrure d’arsenic, également connu sous le nom d’arsine, est un gaz incolore et toxique, plus lourd que l’air, qui a été utilisé en association avec d'autres gaz dans les obus chimiques de la Première Guerre mondiale.
Sommaire
Réactivité chimique
Inodore à l’état naissant, il prend par oxydation au contact de l’air, une odeur aillacée détectable à partir de 0,5 ppm. Il est soluble dans l’eau et dans de nombreux liquides organiques. C’est un composé stable et sa dissociation en hydrogène et Arsenic très lente à température ambiante n’est vraiment sensible qu’à partir de 230 °C. Sa décomposition est favorisée par l’action simultanée de l’humidité et de la lumière ou la présence de certains catalyseurs comme l’alumine. On peut distinguer les arsines aliphatiques (solides à température ambiante) et les arsines aromatiques (liquides). Il peut réagir violemment avec les oxydants forts ( eau de brome, eau de javel, acide nitrique, permanganate de potassium). Ces réactions peuvent aller jusqu’à l’explosion avec le fluor, le chlore, le trichlorure d’azote . Il n’est pas corrosif pour les métaux usuels, sauf l’aluminium.
Historique
Les propriétés toxiques de l'arsenic semble connues depuis l'antiquité, d'où son usage en tant que pesticide.
Les arsines ont été utilisés comme arme chimique sous forme de
- chlorure de diphénylarsine ou (C6H5)2AsCl, dit Clark 1 comme Vomitif et sternutatoire, à partir du 11 juillet 1917, par l'armée allemande ;
- cyanure de diphénylarsine ou (C6H5)2AsCN, irritant violent, vomitif et sternutatoire, sous le nom de Clark 2 à partir du 20 mai 1918, également par l'armée allemande.
Production
On peut préparer l’arsine par protolyse de composés contenant un métal electropositif associé à l’arsenic. L’arsine est un gaz toxique qui s’enflamme facilement dans l’air mais ses analogues organiques (radical aryle ou alkyle) sont beaucoup plus stables ce qui permet de les utiliser en chimie des métaux ou pour doper le silicium dans l’industrie des composants.
Utilisations
Usages guerriers : c'est un gaz qui a été massivement utilisé par l'armée allemande, en association avec d'autres gaz, dans les obus chimiques de la Première Guerre mondiale. Irritant et sternutatoire, associé à l'ypérite, et diffusé en aérosol assez fin pour passer la barrière des filtres de masques à gaz, il forcait les soldats à tousser, éternuer ou vomir dans leur masque à gaz, et donc à ôter leur masque et respirer de l'ypérite ou un autre toxique diffusé par les obus. Puis d'autres formes d'arsines ont été testées et utilisées avec des effets devenir de plus en plus durs pour produire des gaz irritantes et des gaz vésicants.
Des arsines à la fois vésicantes et sternutatoires ont été développées (dichlorure d’éthylarsine et dibromure d’éthylarsine) et utilisées dès de mars 1918. Ces « gaz » induisent une forte détresse respiratoire, accompagnée de crampes au niveau de la poitrine générant un fort sentiment d'angoisse, ces symptômes pouvant perdurer jusqu'à 24 heures. À l'état liquide, elles avaient en plus une action vésicante. Du dichlorure de phénylarsine a aussi été utilisé à partir de novembre 1917, qui ajoutait un effet vomitif irrépréssible aux effets des gaz précédents. La peau des soldats les plus exposés aux vapeurs (près du point d'impact) se couvrait de phlyctènes douloureux. Dans les années qui sont suivi la guerre on a aussi constaté que ces gaz était cancérigènes[6].
Ces gaz agissaient quelques minutes après l'exposition, principalement par contact avec les muqueuses respiratoires et avec les yeux (vive irritation) pour ne s'atténuer qu'après plusieurs heures. Une exposition plus prolongée pouvait provoquer dyspnée asthmatiforme aggravant les effets de l'ypérite. Après guerre, certains de ces obus ont été démantelés engendrant de très graves pollution des sols (hautes teneurs en arsenic, par exemple à Verdun [7]) qui ont persisté jusque dans les années 2000. De grandes quantités d'obus chimiques ont été jetés en mer, où après quelques décennies de corrosion des obus, ils commencent à être à l'origine d'une pollution marine[8].Le trihydrure d’arsenic est utilisé dans l’industrie des composants électronique pour le dopage des semi-conducteurs, ainsi que dans la chimie organique de synthèse.
De nombreuses opérations industrielles peuvent occasionner le dégagement d’hydrogène arsenié :
- traitement de minerais arsenicaux ou de minerais contenant des impuretés d’arsenic (zinc surtout, mais également cuivre, étain ou plomb),
- fonderies de métaux ferreux, fonderies d’étain et de zinc, électrolyse,…
- détartrage acide de chaudières,
- bronzage d’art (traitement de pièces métalliques dans des solutions acides contenant de l’arsenic),
- restauration de peintures contenant des pigments arsenicaux.
Toxicocinétique
Le dihydrure d’arsenic est absorbé essentiellement par inhalation et pénètre par diffusion passive dans les poumons. Il se concentre surtout dans le sang, le foie, les poumons, les reins et est éliminé dans les urines.
Effets sur la santé
Le trihydrure d’arsenic est un gaz très toxique par inhalation ou même par contamination cutanée et qui peut être à l’origine d’intoxications mortelles. Il se lie à l’hémoglobine, entraînant une hémolyse et une anémie aigue.
La toxicité est principalement hématologique et rénale ( Insuffisance rénale aigue par hémoglobinurie) mais aussi neurologique et pulmonaire. La durée de latence avant l’apparition des premiers symptômes est d’autant plus courte que l’intensité de l’exposition est plus élevée. Une exposition à 250 ppm est rapidement fatale et des symptômes non spécifiques peuvent apparaître dès 0,5 ppm.
Dans les formes légères, consécutives à une exposition prolongée à de faibles expositions peuvent s’associer des signes peu évocateurs tels céphalées, douleurs musculaires, nausées.
Dans les formes aigues marquées on constate en outre des vertiges, des frissons, des vomissements, des douleurs abdominales. La gravité de l’intoxication dépend de l’importance de l’hémolyse : anémie hémolytique (élévation de la bilirubine non conjuguée, hémoglobinurie). L’atteinte rénale peut compléter le tableau, allant de l’hémoglobinurie modérée (urines rouges) à l’insuffisance rénale aigue par néphropathie tubulo-interstitielle (avec oligurie puis anurie). Il peut également apparaître une atteinte hépatique vers le 2ème ou 3ème jour avec une élévation modérée des transaminases rapidement réversible. Des atteintes cardiovasculaires (avec anomalies de l’électrocardiogramme) et pulmonaire (œdème pulmonaire transitoire) peuvent également survenir. On retrouve parfois des séquelles à type de neuropathie périphérique et d’insuffisance rénale chronique.
L’intoxication chronique est exceptionnelle.
En France le ministère du travail a fixé une valeur moyenne d’exposition (VME) à 0, 05 ppm et une valeur limite d’exposition (VLE) à 0,2 ppm.
Voir aussi
Articles connexes
Liens externes
- (fr)Fiche INRS
- (fr)Fiche internationale de sécurité
- (fr)Fiche de données de sécurité
- (en)International Chemical Safety Card 0222
- (en)Données sur l'arsenic, par Air Liquide
- (en)IARC Monograph "Arsenic and Arsenic Compunds"
- (en)NIOSH Pocket Guide to Chemical Hazards
Notes et références
- ↑ a , b , c , d , e , f et g ARSINE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ ESIS. Consulté le 30 novembre 2008
- ↑ Entrée du numéro CAS « 7784-42-1 » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 novembre 2008 (JavaScript nécessaire)
- ↑ « Arsine » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Page consacrée aux armes chimiques de la première guerre mondiale, page sur les irritants/sternutatoires
- ↑ article relatif à un record de pollution par l'arsenic, faisant suite au démantèlement d'obus d'arsines après 1918
- ↑ pollution par exemple démontrée et étudiée en Baltique par la commission Helcom
- Portail de la chimie
Catégories : Composé de l'arsenic | Produit chimique très toxique | Produit chimique extrêmement inflammable | Produit chimique dangereux pour l'environnement | Hydrure
Wikimedia Foundation. 2010.



