- Trichlorure d’azote
-
Trichlorure d'azote
Trichlorure d'azote 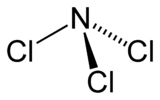
Général No CAS No EINECS Apparence liquide huileux jaune Propriétés chimiques Formule brute NCl3 Masse molaire 120,366 g∙mol-1
Cl 88,36 %, N 11,64 %,Propriétés physiques T° fusion -40 °C T° ébullition 71 °C Solubilité insoluble dans l'eau
soluble dans le benzèneMasse volumique 1,653 Précautions Directive 67/548/EEC 
ESIMDUT[1] 
Unités du SI & CNTP, sauf indication contraire. Le trichlorure d'azote, également connu sous les noms de trichloramine, trichlorine nitrure, est un composé chimique avec la formule NCl3.
Il est le plus souvent rencontré comme un sous-produit de réactions chimiques entre les dérivés d'ammoniac et de chlore.
Par exemples : dans les piscines, entre le chlore des désinfectants et l'urée dans l'urine (ou la sueur) des baigneurs. Le trichlorure d'azote peut se former en faibles quantités lorsque les toilettes sont désinfectés avec la monochloramine.À l'état pur, NCl3 est très réactif.
Il a été utilisé comme gaz lacrymogène.Sommaire
Structure
Comme l'ammoniac, le trichlorure d'azote présente une molécule pyramidale.
La distance N-Cl est de 176 pm, et l'angle Cl-N-Cl est de 107°.
L'électronégativité (sur l'échelle de Pauling) est très similaire pour l'atome d'azote (3,04) et de chlore (3,16).Préparations
Le trichlorure d'azote est préparé par le traitement des sels d'ammonium, tels que le nitrate d'ammonium avec du dichlore :
14 NH4NO3 + 5 Cl2 → 2 NCl3 + 4 NH4Cl + 20 H2O + 22 NO
Ou bien de l'ammoniac avec du dichlore :
4 NH3 + 3 Cl2 → NCl3 + 3 NH4Cl
La (mono-)chloramine et la dichloramine, NH2Cl et NHCl2 respectivement, sont présents lors de cette réaction.
Réactions
Le trichlorure d'azote est un corps instable, dans l'eau il s'hydrolyse (rapidement dans l'eau chaude) en ammoniac et en acide hypochloreux, selon la réaction :
NCl3 + 3 H2O → NH3 + 3 HOCl
Il est aussi explosif, son enthalpie de formation étant de +232 kJ/mol, il se décompose alors directement en azote et en chlore :
2 NCl3 → N2 + 3 Cl2
Références
- ↑ « Trichlorure d'azote » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Portail de la chimie
Catégories : Produit chimique explosif | Composé de l'azote | Chlorure
Wikimedia Foundation. 2010.
