- Phase solide
-
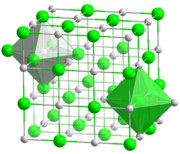
État solide
L’état solide est un des états de la matière caractérisé par l'absence de liberté entre les molécules ou les ions (métaux par exemple).
Les critères macroscopiques de la matière à l'état solide sont :
- le solide a une forme propre,
- le solide a un volume propre.
Si un objet solide est ferme, c'est grâce aux liaisons entre les atomes, ions ou molécules composants du solide.
Par exemple les liaisons covalentes lient les atomes de carbone d'un diamant. Les liaisons covalentes sont normalement difficiles à déformer. Les solides purement covalents sont normalement assez durs.
Il existe aussi les liaisons ioniques, entre des ions de charges opposés. Elles assurent la cohésion d'un grain de sel par exemple, grâce à la liaison entre les ions positifs de sodium et négatifs de chlorure. L'alumine est un exemple de liaisons ioniques très résistantes. Cependant les ions de même signe se repoussent. Donc si un choc ou une déformation rapproche les ions de même signe, le solide ionique peut casser.
Les liaisons métalliques rendent aussi la matière solide à température normale (à l'exception du mercure). Les liaisons métalliques se forment entre n'importe quel atome métallique et dans n'importe quelles positions relatives des atomes. Donc les solides métalliques sont plus malléables.
Des liaisons plus faibles comme les liaisons hydrogène rendent la matière solide à des températures peu élevées (exemple : la glace).Certaines liaisons encore plus faibles, comme les liaisons de Van der Waals ne rendent la matière solide qu'à de très basses températures (exemple dioxygène).
Certains solides résultent de plusieurs sortes de liaisons. Quelques exemples :La pyrite a des liaisons partiellement covalents et partiellement métalliques entre le fer et le soufre.
Dans beaucoup de roches et de verre il y a des liaisons partiellement covalentes et partiellement ioniques dans les ions silicates, phosphates ou sulfates et aussi des liaisons ioniques entre ces anions et les cations sodium, potassium, magnésium et calcium.
Le papier a des liaisons covalentes dans les fibres de cellulose, et des liaisons hydrogènes entre les fibres. Les fibres de cellulose peuvent se séparer dans l'eau car ces liaisons hydrogènes se forment préférentiellement avec l'eau plutôt qu'avec les fibres voisines.Beaucoup des polymères comme le polyéthylène ou le teflon ont des liaisons covalentes entre les atomes de carbone dans leurs chaînes, mais des liaisons de Van der Waals entre les chaînes. Ils sont thermoplastiques car lors du moulage à chaud les chaînes glissent facilement entre elles dans le moule.
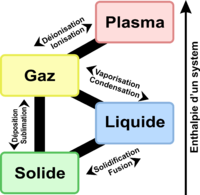
Cependant, il ne faut pas considérer le solide comme un état figé de la matière car les atomes vibrent autour de leur position d'équilibre. Avec la température ces vibrations augmentent jusqu'à rompre les liaisons lors de la fusion, la sublimation ou la pyrolyse du solide.
Les solides ont une faible dilatation et une faible compressibilité.
La plupart des solides sont des cristaux, et le modèle du cristal permet de se faire une bonne idée de l'état solide : les atomes sont disposés dans l'espace de manière régulière et ordonnée. Les distances entre les atomes restent constantes. On parle d'ordre à longue distance.
Cependant, certains solides comme le verre sont amorphes : ils n'ont pas d'atomes rangés régulièrement comme dans un cristal.Voir aussi
Articles connexes
- cristallographie, cristal, minéral, roche, sel, dépôt solide
- sable, grain, granulométrie
- bois, cendre
- Portail de la physique
Catégories : Phase | Physique du solide
Wikimedia Foundation. 2010.