- Paraldéhyde
-
Paraldéhyde 
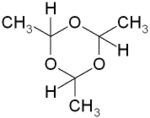
Général Nom IUPAC 2,4,6-trimethyl-1,3,5-trioxane Synonymes p-Acétaldéhyde
ParacétaldéhydeNo CAS No EINECS No RTECS FEMA Apparence liquide incolore, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C6H12O3 [Isomères] Masse molaire[3] 132,1577 ± 0,0065 g·mol-1
C 54,53 %, H 9,15 %, O 36,32 %,pKa 0,3 Moment dipolaire 1,43 ± 0,07 D [2] Propriétés physiques T° fusion 12,6 °C[1] T° ébullition 124,5 °C[1] Solubilité Solubilité dans l'eau à 13 °C : 120 g·l-1 Masse volumique 0,9943 g·cm-3 [4] T° d'auto-inflammation 235 °C[1] Point d’éclair 24 °C (coupelle fermée)[1] Limites d’explosivité dans l’air 1,3–17,0 %vol[1] Pression de vapeur saturante 1 kPa (20 °C) Thermochimie Cp Propriétés optiques Indice de réfraction  1,4049 [4]
1,4049 [4]Précautions Directive 67/548/EEC 
FPhrases R : 11, Phrases S : 2, 9, 16, 29, [6] Transport - 1264 NFPA 704 SIMDUT[7] Produit non classifié SGH[8] 
DangerÉcotoxicologie LogP 0,67[1] Composés apparentés Anions apparentés CH3COOH
CCl3COOHUnités du SI & CNTP, sauf indication contraire. Le paraldéhyde (C2H4O)3 est un liquide bouillant à 125 °C obtenu par polymérisation de l'éthanal. Il se présente sous forme d'un liquide piquant incolore à jaune pâle, assez peu soluble dans l'eau mais très soluble dans l'alcool. Synthétisé pour la première fois par Wildenbusch, il est utilisé aussi bien dans le domaine industriel que médical. Le paraldéhyde, sous l'action de la température, se décompose à l'air en brunissant et en produisant de l'acétaldéhyde et une odeur d'acide acétique. Il réagit activement avec la plupart des plastiques et caoutchoucs.
Sommaire
Propriétés
Le paraldéhyde est un trimère qui se présente sous la forme d'un cycle alterné de six atomes de carbone et d'oxygène avec un atome d'hydrogène et un groupe méthyl relié à chaque atome de carbone. Le tétramère (CH3CHO)4 est le métaldéhyde dont la structure est proche du trimère, mais avec un cycle à 8 entités.
Préparation
On le prépare à des fins commerciales par polymérisation de l'acétaldéhyde en présence d'une faible quantité d'acide sulfurique. Il est ensuite neutralisé par du carbonate de calcium puis purifié par distillation fractionnée.
Utilisations
- solvant pour graisses, huiles, cires, caoutchouc, résines
- produit de remplacement de l'acétaldéhyde.
- produit intermédiaire en chimie organique (accélérateurs de vulcanisation, oxydants pour le caoutchouc, etc.
- médicament (sédatif, somnifère)
Applications médicales
Le paraldéhyde a été introduit dans la pratique clinique par le médecin italien Vincenzo Cervello en 1882. Il agit comme dépresseur du système nerveux central et anticonvulsant. C'est un somnifère et un sédatif efficace. Il a été prescrit dans la médecine contre la toux comme expectorant. Il a été largement utilisé pour faciliter le sommeil des patients souffrant de delirium tremens bien qu'il ait été remplacé depuis par d'autres composés. Jusque dans les années 60, il a été un des somnifères les plus sûrs, employé pour endormir les patients en hôpital psychiatrique et en gériatrie. Environ 30 % de la dose administrée s'évacue par les poumons et le reste par le foie, ce qui donne une mauvaise odeur à l'haleine. Aujourd'hui, le paraldéhyde est utilisé d'une manière non systématique dans le traitement de l'épilepsie. Contrairement au diazépam et autres benzodiazépines, il n'altère pas la respiration à des doses thérapeutiques.
Le médicament générique du paraldéhyde est disponible en ampoules de verre scellées sous le nom de Paral® aux États-Unis.
Posologie
On peut prescrire le paraldéhyde de manière orale, rectale, ou par injection intraveineuse ou intramusculaire. Comme il réagit avec le caoutchouc et le plastique, cela limite le temps de contact du liquide avec les seringues avant injection.
- par injection: Les injections intramusculaires peuvent être très douloureuses et peuvent conduire à des abcès, à une altération des nerfs ou à une nécrose des tissus. Une injection intraveineuse peut déclencher un œdème pulmonaire, un arrêt circulatoire ou d'autres complications.
- par ingestion orale: Le paraldéhyde laisse dans la bouche une sensation de brûlure qui peut endommager l'estomac. C'est pourquoi on le mélange au préalable, à l'aide d'une cuillère métallique, avec du lait ou du jus de fruit dans une tasse en verre .
- par application rectale: La préparation consiste à mélanger une partie de paraldéhyde avec 9 parties de solution saline. Une autre posologie possible est un mélange à parts égales d'huile d'arachide ou d'huile d'olive. ce mélange ne peut être préparé à l'avance, ce qui augmente le temps de préparation.
Liens internes
Liens externes
- Commission de la santé et de la sécurité du travail.
- Fiches internationales de sécurité chimique.
- (en) Paraldehyde Injection B.P Data Sheet
- (en) Drugs.com: Paraldehyde
- (en)Paraldehyde Chemical Data
- Fiche sécurité Baker Fischer
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « paraldehyde » (voir la liste des auteurs)
Notes et références
- PARALDEHYDE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, 2005, 16e éd., 1623 p. (ISBN 0071432205), p. 2.289
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co. (ISBN 0-88415-858-6)
- « 2,4,6-triméthyl-1,3,5-trioxanne » sur ESIS, consulté le 18 février 2009
- « Paraldéhyde » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Catégories :- Produit chimique facilement inflammable
- Aldéhyde
- Acétal
- Médicament
- Solvant
Wikimedia Foundation. 2010.





