- Acétal
-
Acétal et cétal
Les acétals sont obtenus par addition nucléophile d'un alcool sur un aldéhyde en milieu acide, suivie d'une élimination d'eau. Les cétals sont obtenus par le même type de réaction effectuée sur les cétones.
Voici un exemple mettant en jeu l'éthanal et l'éthanol :
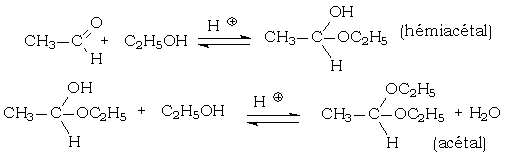
En dehors des formes pyranosiques et furanosiques des oses, et d'autres composés cycliques, les hémiacétals ne sont jamais isolés.
Sommaire
Addition nucléophile d'alcools et de thiols
Observations expérimentales
La méthode utilisée habituellement consiste à déplacer l'équilibre
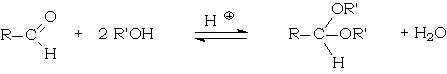
en éliminant l'eau qui est un des produits de la réaction. Pour cela, il est fait usage de l'appareil de Dean Stark.
Le réacteur contient, dans un solvant aprotique apolaire (benzène, toluène), le dérivé carbonylé, l'alcool (ou le diol, thiol...), un acide soluble dans ce solvant (acide paratoluènesulfonique). L'eau est extraite par entraînement azéotropique grâce à la formation d'un mélange ternaire benzène-alcool-eau.
Les résultats varient selon la nature du dérivé carbonylé (aldéhyde ou cétone) et la nature de l'alcool (monoalcool, diol, thiol, dithiol,...)
Voici un tableau récapitulatif :
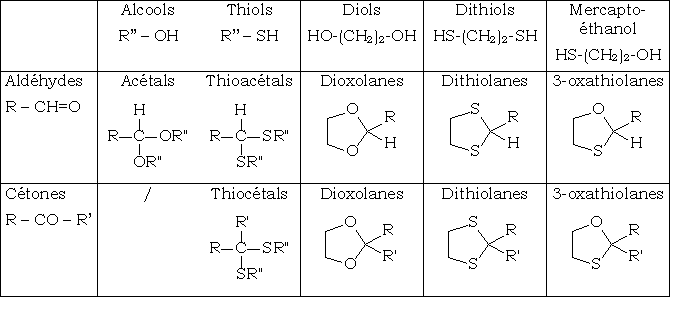
Cette réaction n'a pas lieu avec les acides et leurs dérivés. On ne peut donc attendre la formation des orthoesters (R - C(O-R')3 à partir des esters par cette méthode.
La synthèse des cétals et acétals peut également être conduite dans des conditions totalement anhydres par réaction du dérivé carbonylé avec un alcoxytriméthylsilane, réaction catalysée par le trifluorométhylsulfonate de triméthylsilyle :
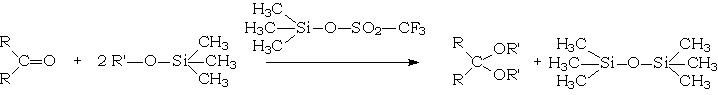
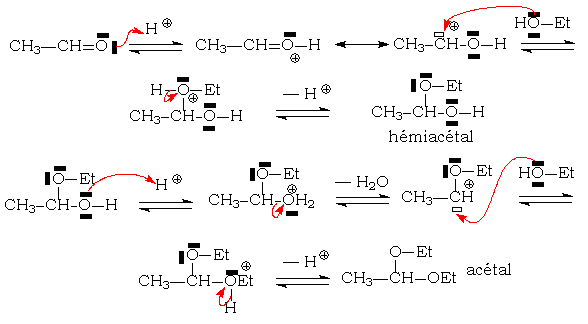
Mécanisme réactionnel
Cet exemple est applicable aussi bien à la synthèse des cétals ou de thio(a)cétals. On constatera que cette réaction d'addition nucléophile ne peut être catalysée que par les acides, dissociés ou non (catalyse acide généralisée)
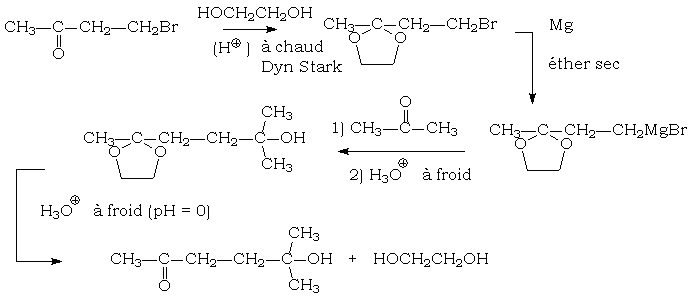
Intérêt en synthèse organique
L’intérêt de la formation de ces acétals et cétals consiste en leur stabilité vis-à-vis des nucléophiles (bases alcalines, organométallique, ions hydrures).
On pourra ainsi protéger un groupement carbonyle, si on doit faire réagir un autre groupement de la molécule en milieu basique (généralement, les bases provoquent la formation plus ou moins complète d'un énolate, ce que l’on veut éviter).
Par exemple :
Déprotection du dérivé carbonylé
Hydrolyse des acétals, des cétals et des thioacétals
Elle ne peut être réalisée qu'en milieu acide. La vitesse de cette réaction dépend de la nature de l'hétéroatome.
Les acétals et cétals, tels les dioxolanes, sont très rapidement hydrolysés à pH=1 et à température ordinaire.
Par contre les thiocétals (oxathiolanes et dithiolanes par exemple) demanderont des conditions plus dures (température plus élevée ou temps de réaction plus important) pour être hydrolysés.
Cependant, la présence dans le milieu réactionnel de réactifs électrophiles qui se fixent sur le soufre et diminuent la stabilité de la liaison carbone-soufre va faciliter l'hydrolyse. Ainsi le cation nitrosyle NO+ [1]:
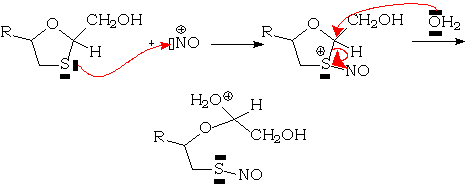
Les oxydants, qui sont eux-mêmes des électrophiles, oxydent les acétals soufrés. Ainsi les 3-oxathiolanes sont-ils partiellement oxydés en S-oxy-3-oxathiolanes par les oxydants métaboliques.
Déprotection en milieu anhydre
Les oxathiolanes sont les plus appropriés pour permettre une restitution du dérivé carbonylé en milieu non aqueux. En effet, le traitement de ces composés par le zinc dans l'éthanol permet cette opération, grâce à la formation de sulfure de zinc.
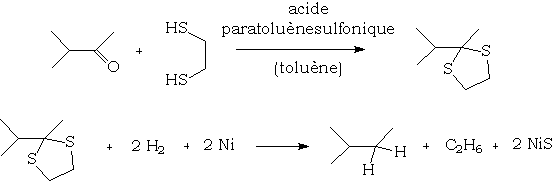
Réduction
Les acétals et cétals soufrés (thioacétals et thiocétals) sont réduits de manière intéressante par l'hydrogène en présence de Nickel de Raney, cette réaction permettant de passer de manière simple d'un dérivé carbonylé à un alcane :
Utilisation pharmaceutique de ces composés
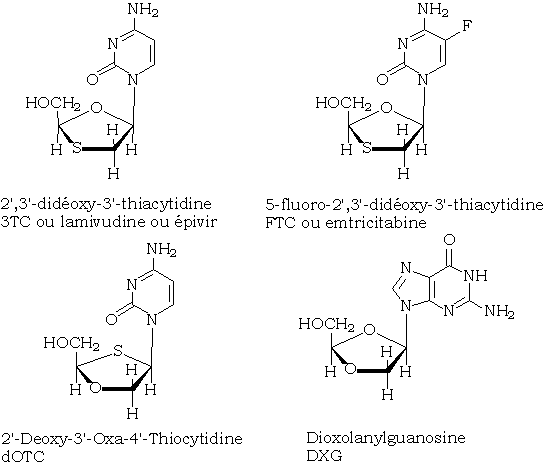
De nombreux acétals (lamivudine, emtricitabine,...) sont actuellement utilisés en tant qu'antirétroviraux. Leur hydrolyse facile en milieu légèrement acide et la présence d'un excès d'électrophiles dans les cellules atteintes contribue certainement à leur efficacité.
Autres utilisations
Les acétals sont employés en parfumerie soit pour leurs qualités olfactives (le vert lilas est le diacétal de l'aldéhyde phénylacétique), soit pour la stabilisation, vis-à-vis de l'oxydation, d'aldéhydes fragiles. Deux polyacétals sont important dans l'industrie: le polyformol linéaire qui est un plastique technique utilisé pour la fabrication de pièces moulées et le polybutyral qui est l'acétal du butanal et de l'alcool polyvinylique et qui, sous forme de film, intervient dans la fabrication de verre de sécurité comme le triplex.
Annexes
Articles connexes
Notes et références
- ↑ CAREY SUNDBERG . Chimie Organique Avancée, Tome 2, page 691. DeBoeck Université 1997
- Portail de la chimie
Catégories : Composé organique | Groupe fonctionnel | Acétal
Wikimedia Foundation. 2010.
