- Isocyanate de méthyle
-
Isocyanate de méthyle 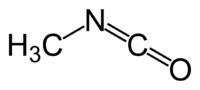
Général Nom IUPAC Isocyanate de méthyle No CAS No EINECS Apparence liquide incolore volatil, d'odeur âcre[1]. Propriétés chimiques Formule brute C2H3NO [Isomères] Masse molaire[3] 57,0513 ± 0,0023 g·mol-1
C 42,11 %, H 5,3 %, N 24,55 %, O 28,04 %,Moment dipolaire ≈2,8 D[2] Propriétés physiques T° fusion -80 °C[1] T° ébullition 39 °C[1] Solubilité dans l'eau à 20 °C : réaction[1] Masse volumique 0,96 g·cm-3[1] T° d'auto-inflammation 535 °C[1] Point d’éclair -7 °C (coupelle fermée)[1] Limites d’explosivité dans l’air 5,3–26 %vol[1] Pression de vapeur saturante à 20 °C : 54 kPa[1] Point critique 55,7 bar, 217,85 °C[4] Thermochimie Cp Précautions Directive 67/548/EEC 
T+
F+Phrases R : 12, 24/25, 26, 37/38, 41, 42/43, 63, Phrases S : (1/2), 26, 27/28, 36/37/39, 45, 63, Transport - 2480 NFPA 704 SIMDUT[6] 


SGH[7] 



DangerÉcotoxicologie Seuil de l’odorat bas : 2,1 ppm[8] Unités du SI & CNTP, sauf indication contraire. L’isocyanate de méthyle est un composé organique de formule développée H3C-N=C=O.
C’est un intermédiaire notamment utilisé pour la synthèse des carbamates insecticides tels que l’aldicarbe, le carbaryl le méthomyl ou le carbofuran. II intervient également dans la préparation de produits pharmaceutiques et de certains polymères.
C’est un produit dangereux en raison de sa toxicité et de son pouvoir irritant. Il a été à l’origine de la catastrophe de Bhopal qui a causé la mort de plusieurs milliers de personnes.Sommaire
Propriétés physico-chimiques
Dans les conditions normales, l’isocyanate de méthyle est un liquide incolore d’odeur âcre. Il est très volatil et ses vapeurs sont lacrymogènes. Il a une température d’ébullition relativement basse (39 °C) et est hautement inflammable. Il est faiblement soluble dans l’eau (6 à 10 % en masse) mais cette solution n’est pas stable car il réagit avec l’eau.
Production
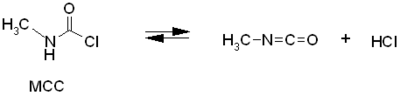
L’isocyanate de méthyle est généralement fabriqué à partir de la méthylamine et du phosgène. Ces produits réagissent à température ambiante mais pour des productions à l'échelle industrielle les réactifs sont mis en présence sous forme gazeuse à plus haute température. Il se forme initialement du chlorure de N-méthyl carbamoyle (MCC) et du chlorure d'hydrogène.
.

L'isocyanate de méthyle est ensuite obtenu en traitant le MCC avec une amine tertiaire comme la diméthylaniline ou avec la pyridine. On peut aussi le séparer par distillation.
Sécurité
- produit extrêmement inflammable.
- toxique par inhalation, par contact de la peau et par ingestion.
- irritant pour les yeux, les voies respiratoires et la peau.
- conserver le récipient dans un endroit bien ventilé.
- ne pas verser de l'eau dans ce produit.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Methyl isocyanate » (voir la liste des auteurs)
- ISOCYANATE DE METHYLE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 0-88415-857-8)
- « Isocyanate de méthyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Methyl isocyanate sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
Annexes
Articles connexes
Liens externes
Catégories :- Produit chimique très toxique
- Produit chimique extrêmement inflammable
- Produit chimique qui réagit avec l'eau
- Produit chimique corrosif
- Insecticide
- Isocyanate
Wikimedia Foundation. 2010.