- Diméthylformamide
-
Diméthylformamide 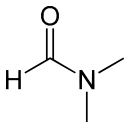
Général Nom IUPAC N,N-dimethylméthanamide Synonymes DMF
N,N-diméthylformamideNo CAS No EINECS DrugBank PubChem ChEBI SMILES InChI Apparence liquide incolore à jaune, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C3H7NO [Isomères] Masse molaire[3] 73,0938 ± 0,0034 g·mol-1
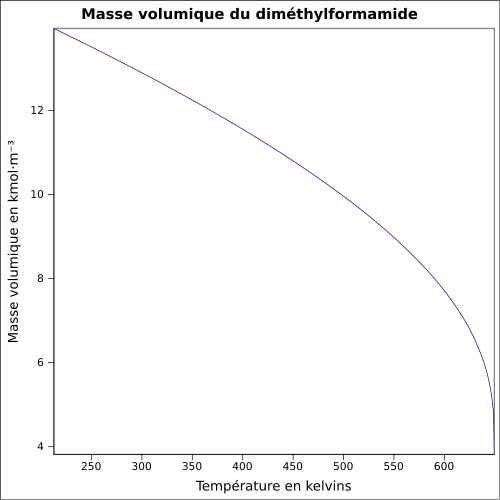
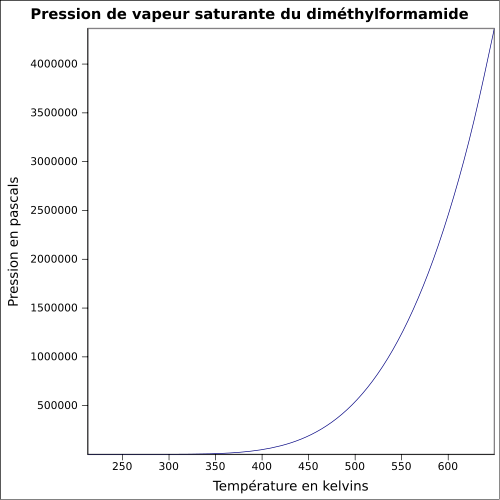
C 49,3 %, H 9,65 %, N 19,16 %, O 21,89 %,Moment dipolaire 3,86 D (25 °C) Diamètre moléculaire 0,595 nm [2] Propriétés physiques T° fusion -61 °C [1] T° ébullition 153 °C [1] Solubilité dans l'eau : miscible[1] Masse volumique T° d'auto-inflammation 445 °C[1] Point d’éclair 58 °C (coupelle fermée)[1] Limites d’explosivité dans l’air 2,2–15,2 %vol [5] Pression de vapeur saturante 3,77 mbar à 20 °C
6,5 mbar à 30 °C
23 mbar à 50 °C
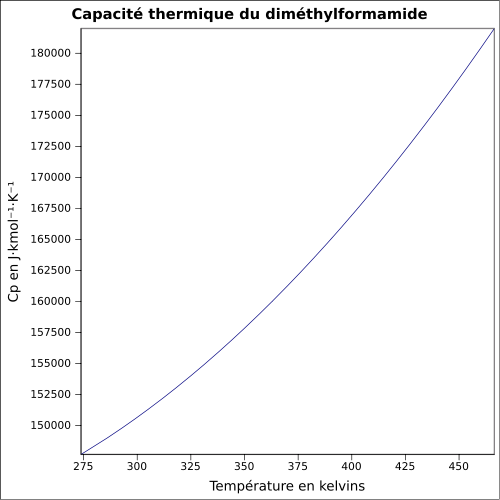
45 mbar à 65 °C [5]Viscosité dynamique 0,92 cP à 20 °C Thermochimie ΔfH0liquide -239,4 kJ·mol-1 [6] ΔfusH° 8,950 kJ·K-1·mol-1 à -60,3 °C [6] ΔvapH° 47,75 kJ·K-1·mol-1 à 25 °C [6] Cp 146,05 J·K-1·mol-1 à 25 °C [6] PCI -1 941,6 kJ·mol-1 [6] Propriétés électroniques Bande interdite Constante dielectrique 36,70 Précautions Directive 67/548/EEC[5] 
TPhrases R : 20/21, 36, 61, Phrases S : 45, 53, Transport[5] 30 2265 NFPA 704 SGH[9] 
DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[8] Écotoxicologie LogP -1,01 [5] Seuil de l’odorat bas : 0,47 ppm
haut : 100 ppm[10]Unités du SI & CNTP, sauf indication contraire. Le diméthylformamide ou N,N-diméthylméthanamide est un solvant courant en chimie organique de formule HCO-N(CH3)2
Communément abrégé DMF, ce liquide incolore est miscible à l'eau et à la majorité des liquides organiques. C'est un solvant aprotique polaire à haut point de fusion/ébullition utilisé couramment pour les réactions chimiques. Le DMF est un amide dérivé de l'acide formique et de la diméthylamine. Il facilite les réactions de SN2 notamment.
Il peut être synthétisé à partir de l'acide formique et de la diméthylamine. Il n'est pas stable en présence de base forte comme la soude (hydroxyde de sodium) ou d'acide fort comme l'acide sulfurique, ou encore l'acide chlorhydrique. À haute température, il se décompose en acide formique et dimethylamine. Le DMF pur est inodore tandis qu'il acquiert souvent une odeur de poisson lors de sa dégradation, en raison de la présence de diméthylamine.
Sommaire
Structure et propriétés
Du fait de la contribution de 2 formes de résonance possibles l'indice de liaison de la liaison carbonyle C=O est diminuée, tandis que celui de la liaison carbone-azote est augmenté. Ainsi, le spectre IR du DMF laisse apparaître une bande plus basse (de fréquence 1 675 cm-1[11]) que celle d'un groupement carbonyle (C=O) non substitué. Aussi, à cause du caractère partiellement double de la liaison C-N, la rotation autour de son axe est gênée, et lente. Les deux méthyles ne sont donc pas équivalents en spectroscopie RMN (faisant apparaître 2 singulets de 3 protons, au lieu d'un seul singulet de 6 protons).
Applications
On utilise tout d'abord le DMF en tant que solvant, en raison de son haut point d'ébullition. Il est aussi utilisé dans la production de fibres acryliques et de plastiques. On l'utilise également afin de coupler des peptides dans l'industrie pharmaceutique, dans la production de pesticides, colles, cuirs synthétiques, fibres, films, et revêtements[12].
Le DMF est un réactif pour la synthèse des aldéhydes de Bouveault, ainsi que dans la réaction de Vilsmeier-Haack, une des méthodes les plus employées dans la formation d'aldéhydes aromatiques. Le DMF pénètre beaucoup de matières plastiques et les fait gonfler. Il est donc fréquemment utilisé comme composant des dissolvants de peintures.
Production
Il est produit par la réaction de la diméthylamine et du monoxyde de carbone à basses pression et température en conditions catalytiques[réf. nécessaire].
Précautions
La réaction entre l'hydrure de sodium et le DMF est quelque peu dangereux[réf. nécessaire] ; dès 26 °C, on observe une décomposition exothermique. En laboratoire, tout dégagement de chaleur est (en principe) rapidement compensée et mis sous contrôle par un bain de glace et ceci reste une combinaison de réactifs courante. On a recensé plusieurs accidents.
Toxicité
Le DMF a été corrélé au cancer chez l'humain[réf. nécessaire], et on le suppose à l'origine de défauts de naissance. Dans certains secteurs de l'industrie, les femmes sont écartées de l'utilisation du DMF. Pour beaucoup de réactions, il peut être remplacé par le DMSO (Diméthylsulfoxyde), le DMAC (Diméthylacétamide) ou la NMP (N-méthyl-2-pyrrolidone). Attention cependant : le NMP a récemment été classé reprotoxique par l'European Chemical Bureau[13] . D'après l'IARC (International agency for research on cancer), le DMF pourrait être une substance cancérigène, bien que l'agence de protection de l'environnement ne le considère pas comme un risque de cancer.
Codes de classement
- ICSC : 0457 04
- PGCH : 0226
Notes et références
- N, N - DIMETHYLFORMAMIDE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Entrée de « Dimethyl formamide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 1 octobre 2009 (JavaScript nécessaire)
- (en) « Formamide, N,N-dimethyl- » sur NIST/WebBook, consulté le 1 octobre 2009
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 0-88415-857-8)
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Dimethylformamide sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- Spectral Database for Organic Compounds, Dimethylformamide, accessed 27 Jan 2007.
- Redlich, C; Beckett, W. S.; Sparer, J.; Barwick, K. W.; Riely, C. A.; Miller, H.; Sigal, S. L.; Shalat, S. L.; and Cullen, M. R.; 1988. Liver disease associated with occupational exposure to the solvent dimethylformamide. Ann. Intern. Med. 108:680-686. PMID 3358569
- http://ecb.jrc.ec.europa.eu/esis/ taper le n°CAS 872-50-4 dans le champ de recherche
Voir aussi
Articles connexes
Liens et documents externes
- Dimethylformamide usage on Organic Syntheses
- Concise International Chemical Assessment Document 31: N,N-Dimethylformamide
- Material Safety Data Sheet for DMF
- DMF Chronic Toxicity Summary (PDF)
 France(fr)Fiche INRS
France(fr)Fiche INRS
Wikimedia Foundation. 2010.